ВВЕДЕНИЕ
Вирусы гриппа с укороченным неструктурным белком NS1 обладают сниженной репродуктивной активностью в респираторном тракте организма-хозяина, однако могут вызывать полноценный гуморальный и клеточный иммунный ответ, что позволяет использовать эти вирусы для создания живых аттенуированных гриппозных вакцин [1, 2]. Формирование вирусспецифических CD4+ и CD8+ Т-лимфоцитов в легких и лимфоузлах, дренирующих респираторный тракт, а также антител в высоком титре к поверхностным антигенам вируса гриппа с модифицированным геном NS было показано в исследованиях на мышах [3, 4], лошадях [5], свиньях [6, 7], домашней птице [1], хорьках [8] и макаках [9]. Живая интраназальная гриппозная вакцина, разработанная на основе вируса гриппа с удаленной рамкой считывания белка NS1, успешно прошла клинические испытания [2]. Модификация гена NS путем внедрения в его состав фрагментов генома патогенных организмов, не родственных ви-русу гриппа, является перспективным подходом для создания векторных вакцин мукозального применения против различных инфекций. В частности, показано, что иммунизация штаммом, экспрессирующим белок ESAT-6 Mycobacterium tuberculosis в составе NS1, приводит к формированию протективного ESAT-6-специфичного иммунного ответа Th1-типа [10].
Несмотря на большое число исследований, посвященных изучению влияния модификаций белка NS1 на формирование адаптивного иммунитета к вирусу гриппа, до сих пор уделялось недостаточное внимание клеточным реакциям врожденного иммунитета на ранних стадиях иммунного ответа. Именно клетки врожденного иммунитета обеспечивают первую линию иммунной защиты организма при вирусных инфекциях, а также активацию адаптивного иммунитета за счет процессинга и презентации антигенов в составе главного комплекса гистосовместимости (МНС), продукции провоспалительных и регуляторных цитокинов, хемокинов и факторов дифференцировки [11, 12].
Известно, что полноразмерный белок NS1 принимает непосредственное участие в подавлении реакций врожденного иммунного ответа при гриппозной инфекции за счет угнетения экспрессии генов интерферонов I типа и других провоспалительных факторов [13]. Кроме того, действие белка NS1 оказывает влияние на эффективность презентации вирусных антигенов в составе MHC и, как следствие, на иммуногенность белков вируса гриппа [13, 14].
Целью данной работы было сравнение продукции цитокинов воспаления, экспрессии активационных маркеров и динамики относительного состава дендритных клеток, макрофагов, моноцитов и нейтрофилов у мышей, иммунизированных штаммами вируса гриппа А с полноразмерным и укороченным до 124 аминокислотных остатков (а. к.) белком NS1 с последующей оценкой адаптивного Т-клеточного иммунного ответа на указанные штаммы.
С учетом разной репродуктивной активности вирусов с укороченным и интактным белком NS1 в респираторном тракте животных, для данного исследования был выбран интраперитонеальный способ иммунизации мышей, позволяющий нивелировать потенциальные различия в антигенной нагрузке, поскольку вирус гриппа не способен к размножению в перитонеальной полости [15]. Данный подход описан в работе B. Ferko et al., [4], где интраперитонеальная иммунизация мышей вирусами с полноразмерным и модифицированным белком NS1 применялась для оценки цитокиногенного потенциала исследуемых вирусов.
МАТЕРИАЛЫ И МЕТОДЫ
Вирусы
В работе использовали два штамма на основе вируса гриппа А/Puerto Rico/8/1934 (H1N1) (A/PR8), кодирующих (1) полноразмерный белок NS1 (А/PR8/full NS) и (2) укороченный до 124 а. к. белок NS1 (А/PR8/NS124). Вирусы были накоплены в развивающихся куриных эмбрионах (РКЭ) и очищены путем фракционирования в градиенте плотности сахарозы.
Лабораторные животные
Исследование выполняли на мышах линии С57BL/6, полученных из питомника «Столбовая» Научного центра биомедицинских технологий ФМБА (Россия). При проведении исследования соблюдались правила работы с лабораторными животными [16].
Определение инфекционной активности вирусов
Для определения репродуктивной активности исследуемых штаммов в респираторном тракте мышам под легким эфирным наркозом вводили 6.0 log10TCID50/ мышь (tissue culture infective dose, TCID) вирусной суспензии в объеме 30 мкл. Забор легких осуществляли на 2-й, 4-й и 6-й дни после заражения. Для этого мышей умерщвляли путем цервикальной дислокации, после чего извлекали легкие. Органы гомогенизировали с помощью прибора Tissue Lyser II (Qiagen, Германия) при 30 Гц в течение 6 мин. Определение репродуктивной активности штаммов в легких проводили титрованием гомогенатов тканей в культуре клеток MDCK (Madin-Darby Canine Kidney) методом предельных разведений.
Инфекционную активность исследуемых штаммов оценивали методом предельных разведений на культуре клеток почки эмбриона цыпленка (chicken embryo kidney, CEK) в среде DMEM-F12 (Gibco, США), содержащей 6 мM GlutaMAX (Gibco, США), 1 мM СН3(СО)СООNa (Gibco, США) и 1% антибиотик/антимикотик (Gibco, США). Для определения TCID50 использовали 96-луночные культуральные планшеты (Nunc, Дания). В лунки вносили по 100 мкл приготов-ленных разведений вируссодержащего материала, после чего планшеты инкубировали 5 суток при температуре 34°С и 5% СО2. Учет результатов проводили визуально по наличию цитопатического эффекта и контролировали с помощью метода гемагглютинации с использованием 0.5% суспензии куриных эритроцитов. Расчет TCID50 проводили по методу Рида и Менча [17] и выражали в log10TCID50/мл.
Иммунизация животных
Мыши были иммунизированы интраперитонеально суспензией вируса в натрий-фосфатном буфере (PBS, Биолот, Россия) в объеме 500 мкл (7.1 log10TCID50/ мышь). Животные контрольной группы получали PBS в том же объеме.
Анализ продукции цитокинов в перитонеальных смывах
Для забора перитонеальных смывов мышей умерщвляли путем цервикальной дислокации через 12 ч после иммунизации и при помощи шприца вводили в брюшную полость 1 мл холодного PBS. Через 5 мин перитонеальные смывы отбирали и переносили в пробирки. Образцы центрифугировали в течение 10 мин при 500g и температуре 4°С на центрифуге Eppendorf 5810R (ротор-бакет А-4-81). Концентрацию цитокинов воспаления в супернатантах определяли при помощи набора реагентов LEGENDplex Mouse Inflammation Panel Kit в планшетах с V-образным дном лунок (Biolegend, США) в соответствии с инструкциями производителя.
Проточная цитометрия
Для анализа динамики популяций клеток врожденного иммунитета перитонеальные смывы получали через 12 и 24 ч после иммунизации. Для окрашивания флуорохром-конъюгированными антителами использовали 106 клеток в 100 мкл. Для анализа адаптивного иммунного ответа осуществляли забор селезенок и выделение спленоцитов через 8 и 21 день после иммунизации (д. п. и.). Стимуляцию клеток проводили в плоскодонных 96-луночных планшетах (Nunc, Дания) в течение 6 ч при помощи пептида ASNENMETM, соответствующего высокоиммуногенному эпитопу белка NP вируса гриппа А/PR8 в присутствии брефельдина-А (BD Biosciences, США). Для выявления популяций клеток врожден-ного иммунитета и анализа уровня экспрессии активационных маркеров использовали две панели флу-орохром-конъюгированных антител: 1) CD11b-PE/Cy7, CD11c-PE, MHCII-Alexa488, CD103-PerCP-Cy5.5, CD45-APC/Cy7, CD64-BV421, CD24-BV510; 2) CD45APC/Cy7, MHCII-Alexa488, Ly6G-PerCP-Cy5.5, CD86BV421, CD83-BV510 (Biolegend, США). Для определения фенотипа клеток адаптивного иммунитета использовали набор флуорохром-конъюгированных антител: CD4-PerCP-Cy5.5, CD8-PE/Cy7, CD62L-APC/Cy7, CD44-BV421 (Biolegend, США). Внутриклеточную продукцию цитокинов оценивали при помощи антител против IFNγ-FITC, IL2-PE, TNFα-BV510. Окраску для выявления внутриклеточных маркеров осуществляли с использованием набора реагентов Fixation and Permeabilization Solution (BD Biosciences, США) в соответствии с инструкциями производителя. Для идентификации мертвых клеток использовали маркер жизнеспособности Zombie Red (Biolegend, США). Для блокирования неспецифического связывания антител использовали реагент True Stain, содержащий антитела к CD16/CD32 (Biolegend, США). Сбор данных осуществляли на проточном цитометре BD FACSCanto II (BD Biosciences, США). Результаты анали-зировали в программе Kaluza Analiziz 1.5a (Beckman Coulter, США).
Статистический анализ данных
Статистическую обработку результатов проводили в программе RStudio Desktop 1.0.153 (RStudio Inc, США). Для сравнения показателей в нескольких экспериментальных группах с одним контролем использовали критерий Даннета. Сравнение экспериментальных групп между собой осуществляли при помощи t-критерия Стьюдента.
РЕЗУЛЬТАТЫ
Оценка патогенности и репродуктивной активности исследуемых штаммов в респираторном тракте мышей
Для оценки влияния укорочения белка NS1 на патогенность и репродуктивную активность вируса гриппа при интраназальном введении была проведена оценка динамики изменения массы тела мышей, однократно иммунизированных штаммами А/PR8/NS124 и А/PR8/full NS.
Однократная иммунизация животных вирусом с укороченным до 124 а.к. белком NS1 (А/PR8/NS124) не приводила к снижению массы тела (Рис. 1). В то же время иммунизация животных эквивалентной дозой патогенного вируса А/PR8/full NS приводила к снижению массы тела до 85% от исходной к 6-му дню после заражения.

Инди-видуальными символами показаны процентные доли средней массы тела животных в группе относительно исходного показателя средней массы тела в группе (Mean±SEM). Число животных: n=6 в контрольной группе, n=10 в остальных группах.
Результаты определения репродуктивной активности исследуемых штаммов представлены в Таблице 1.
| Название штамма вируса | Вирусовыделение из легких (log10[TCID50]/мл ± SD, n = 5) | ||
|---|---|---|---|
| 2-й день | 4-й день | 6-й день | |
| А/PR8/NS124 | 3.70 ± 0.71*** | 3.80 ± 1.20*** | 4.40 ± 1.85 |
| А/PR8/full NS | 6.80 ± 0.71 | 7.00 ± 0.54 | 6.50 ± 0.67 |
p<0.001, t-критерий Стьюдента
Полученные результаты позволяют заключить, что укорочение белка NS1 ведет к аттенуации вируса, проявляющейся в снижении репродукции вируса в легких и отсутствии снижения массы тела иммунизированных животных. Достоверные различия по выделению вируса были отмечены на 2-й и 4-й д. п. и. (p=0.0008, p=0.003 соответственно), тогда как на 6-й день разница между группами приобретала менее выраженный характер (p=0.08).
Повышенная индукция цитокинов штаммом А/PR8/NS124 по сравнению с А/PR8/full NS
С учетом обнаруженных на первом этапе работы различий в репродуктивной активности между штаммами А/PR8/full NS и А/PR8/NS124 в респираторном тракте мышей для дальнейшего изучения иммуногенности данных вирусов применялся интраперитонеальный способ иммунизации.
Анализ концентрации цитокинов воспаления в перитонеальных смывах мышей через 12 ч после введения исследуемых вирусов показал, что для штамма А/PR8/NS124 характерна более высокая цитокиногенная активность, чем для вируса с полноразмерным белком NS1 (Рис. 2). Наиболее выраженные различия были показаны для IFNβ, продукция которого у мышей из группы NS124 была почти в 300 раз выше, чем у животных из группы full NS (65635.7±14650.3 пг/мл и 223.6±140.3 пг/мл соответственно).Кроме того,существенные различия между двумя экспериментальными группами были получены по уровню IL27: концентрация данного цитокина в перитонеальных смывах мышей, иммунизированных вирусом с укороченным белком NS1, была в 4 раза выше, чем в группе full NS (508.6±193.5 пг/мл и 125.2±64.6 пг/мл соответственно). На фоне иммунизации в обеих группах значительно возрастала продукция IL6 и MCP1, при этом у животных, иммунизированных вирусом А/PR8/NS124, данные показатели в среднем были в 1.8 (IL6) и 2.0 (MCP1) раза выше, чем у мышей, получивших штамм А/PR8/full NS. Аналогичные различия (в 1.5 – 2.0 раза) между группами были получены по уровню цитокинов TNFα, IL2p70, IL1β и GM-CSF. Продукция IFNγ также увеличивалась в обеих экспериментальных группах, однако для мышей, иммунизированных вирусом А/PR8/full NS, были получены более высокие значения концентрации данного цитокина (full NS: 82.2±26.7 пг/мл, NS124: 62.3±27.0 пг/мл, p = 0.09).

Представлены значения по каждому образцу (n=10) и средние значения по каждой группе. Символ * означает наличие достоверных различий между группами full NS и NS124 (*: р<0.05, **: p<0.01, ***: p<0.001, t-критерий Стьюдента).
Основные популяции клеток врожденного иммунитета в перитонеальных смывах мышей
Набор маркеров CD45, MHCII, CD11c, CD11b, CD24, CD64, Ly6G изначально был предложен для идентификации основных популяций клеток врожденного иммунитета в легких [18, 19] и других органах мышей (тонкий кишечник, сердце, почки, печень, периферические органы иммунной системы и др.) [19]. В данной работе этот подход был использован для анализа клеточного состава перитонеальных смывов мышей. Была разработана панель флуорохром-конъюгированных антител, позволяющая дифференцировать макрофаги (CD45+MHCII+ CD64+CD11c/CD11b+), дендритные клетки (CD45+MHCII+CD64-CD24+CD11c/CD11b+), моноциты (CD45+MHCII-CD64+CD11c/CD11b+), нейтрофилы (SSChiCD45+Ly6G+), а также отдельные субпопуляции дендритных клеток по уровню экспрессии маркеров CD11b и CD103 (Рис. 3).

После отсечения дублетов по FSC-A/FSC-H (не показано на рисунке) и выделения популяции живых одиночных клеток на основании характеристик светорассеяния (FSC-A/SSC-A) и связывания красителя Zombie Red иммуноциты гейтировали по наличию маркера CD45. Условные обозначения: ЖК – живые клетки; Лейк. – лейкоциты; АПК – антигенпрезентирующие клетки (CD45+CD11c/CD11b+MHCII+); Мон. – моноциты (CD45+CD11c/CD11b+MHCII-CD64+ CD24); Гран. – гранулоциты (нейтрофилы и эозинофилы, CD45+CD11c/CD11b+MHCII-CD64-CD24+); Нейт. – нейтрофилы (SSChiCD45+Ly6G+); ДК1 – CD11b-дендритные клетки (CD45+CD11c+CD11b-MHCII+CD64-CD24+); ДК2 – CD11bint ДК (CD45+CD11c+/-CD11bintMHCII+CD64-CD24+); ДК3 – CD11bhi ДК (CD45+CD11c+/-CD11bhiMHCII+CD64-CD24+); ДК4 – CD103+ ДК (CD45+CD11c/CD11b+ CD103+MHCII+CD64-CD24+).
Динамика привлечения моноцитов и нейтрофилов в перитонеальную полость мышей
Результаты оценки относительного содержания ос-новных популяций клеток врожденного иммунитета на разных сроках после иммунизации представлены на Рис. 4. Через 12 ч после введения вируса А/PR8/NS124 было отмечено незначительное превышение относительного содержания моноцитов и нейтрофилов по сравнению с контролем,тогда как в группе, иммунизированной А/PR8/full NS, доля данных клеток составила 2.74±2.48 % и 17.65±11.32 % соответственно (в контроле: 0.14±0.10 % и 0.93±0.24 %). Относительный состав макрофагов через 12 ч претерпевал выраженные изменения в обеих экспериментальных группах: был отмечен достоверный прирост содержания клеток по сравнению с контролем в группе full NS (p=0.01) и NS124 (p=0.05). Через 24 ч для обеих групп были получены похожие значения относительного содержания моноцитов и макрофагов, тогда как уровень нейтрофилов в группе NS124 по-прежнему оставался сниженным относительно группы full NS.

Точками отмечены индивидуальные показатели доли исследуемых популяций от общего числа живых CD45+-клеток. Также представлены средние значения по груп-пам (n=5). Символ * означает наличие достоверных различий с контрольной группой (*: р<0.05, **: p<0.01, ***: p<0.001, критерий Даннета). Символом ♦ отмечены достоверные различия между экспериментальными группами full NS и NS124 (♦: р<0.05, ♦♦: p<0.01, ♦♦♦: p<0.001, t-критерий Стьюдента).
Относительное содержание популяций дендритных клеток в перитонеальной полости
Согласно данным, представленным на рис. 3, исполь-зованный в работе набор маркеров позволяет четко разделить популяцию дендритных клеток (CD45+ CD11c/CD11b+MHCII+CD64-CD24+) на 4 субпопуляции на основании уровня экспрессии маркеров CD11b и CD103. Наибольшую долю от общего числа дендритных клеток в перитонеальной полости составляют дендритные клетки, характеризующиеся промежу-точным уровнем экспрессии CD11b (CD11bint ДК).
Через 12 ч после введения вирусов в группе full NS отмечалось достоверное сокращение доли CD11bint ДК по сравнению с контролем (p=0.0009) (Рис. 5). При этом в группе NS124 на данном сроке не было выявлено значимых изменений относительного содержания указанной популяции. Через 24 ч в обеих группах отмечалось достоверное снижение уровня CD11bint ДК (p=0.00002, p=0.00003), однако в группе NS124 из-менения носили менее выраженный характер.
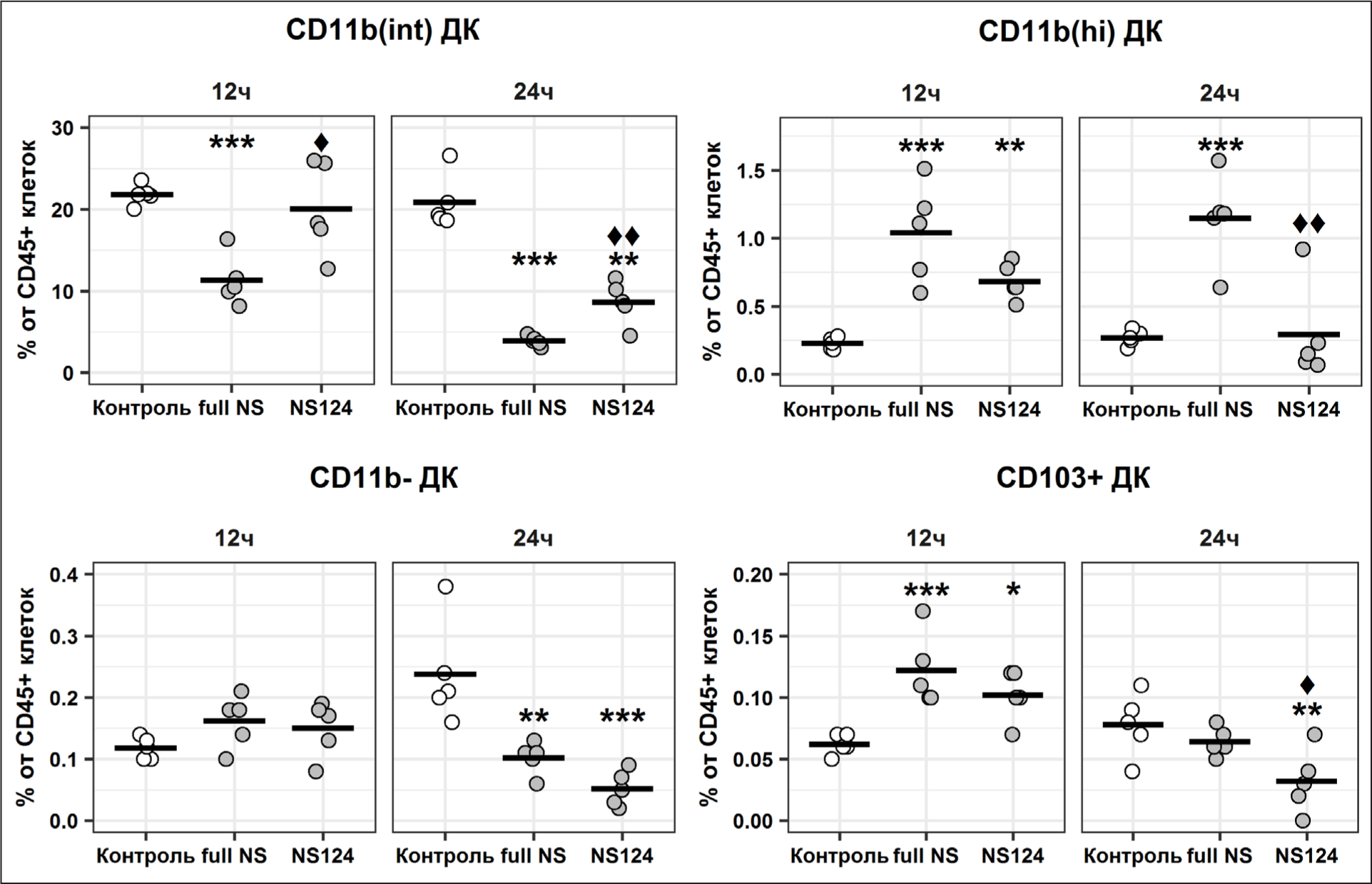
Точками отмечены индивидуальные показатели доли исследуемых популяций от общего числа живых CD45+-клеток. Также представлены средние значения по группам (n=5). Символ * означает наличие достоверных различий с контрольной группой (*: р<0.05, **: p<0.01, ***: p<0.001, критерий Даннета). Символом ♦ отмечены достоверные различия между экспериментальными группами (♦: р<0.05, ♦♦: p<0.01, ♦♦♦: p<0.001, t-критерий Стьюдента).
Минорные популяции дендритных клеток, вклю-чающие CD11bhi ДК, CD11b-ДК и CD103+ ДК, демонстрировали иную реакцию на введение вируса: через 12 ч после иммунизации происходило увеличение относительного содержания указанных популяций, причем в случае CD11bhi ДК и CD103+ ДК раз-личия с контролем были статистически достоверны (full NS: p=0.0001, р=0.0007; NS124: р=0.01, р=0.007). Через 24 ч после иммунизации в группе NS124 происходило сокращение доли всех исследуемых популяций дендритных клеток относительно общего числа CD45+ клеток брюшной полости. В то же время в группе full NS относительное содержание CD11bhi ДК оставалось на повышенном относительно контроля уровне, а доля CD103+ ДК снижалась только до уровня контрольной группы, тогда как в группе NS124 процент данной популяции оказывался существенно ниже, чем в контроле. Таким образом, через 24 ч после иммунизации штаммом A/PR8/NS124 отмечалось достоверное снижение относительного содержания CD11bhi ДК и CD103+ ДК (р=0.004 и р=0.02 соответственно).
Усиление экспрессии костимуляторного фактора CD86
Результаты анализа медианной интенсивности флуо-ресценции (median fluorescence intensity, MFI) актива-ционных маркеров CD83 и CD86 на АПК (CD45+MHCII+) на сроках 12 и 24 ч после иммунизации представлены на Рис. 6. Установлено, что уровень экспрессии CD83 увеличивался в ответ на введение вируса как в группе full NS, так и в группе NS124: уже через 12 ч отмечались статистически значимые различия с контролем (р=0.01, р=0.03), сохранявшиеся и на сроке 24 ч после иммунизации.

На рисунке представлены медианные значения интенсивности флуоресценции (MFI) маркеров CD83 и CD86 по каждому животному. Также представлены средние значения по группам (n=5). Символ * означает наличие достоверных различий с контрольной группой (*: р<0.05, **: p<0.01, ***: p<0.001, критерий Даннета). Символом ♦ отмечены достоверные различия между экспериментальными группами (♦: р<0.05, ♦♦: p<0.01, ♦♦♦: p<0.001, t-критерий Стьюдента).
Уровень экспрессии CD86 значительно возрастал через 12 ч после иммунизации. Значимые различия с контролем были отмечены в обеих экспериментальных группах, причем показатели MFI, полученные на данном сроке, имели близкие значения в группах full NS и NS124. На сроке 24 ч после иммунизации в группе NS124 исследуемый показатель возрастал еще сильнее, обнаруживая статистически значимые различия не только с контрольной группой, но и с группой full NS (p=0.00003 при сравнении с контролем; р=0.006 при сравнении с full NS).
Адаптивный Т-клеточный иммунный ответ
На заключительном этапе исследования была проведена оценка адаптивного Т-клеточного иммунного ответа на иммунодоминантный эпитоп белка NP. Было установлено, что доля антиген-специфических CD8+ Т-клеток в селезенках мышей из группы NS124 в 1.5-2.0 раза превышала аналогичный показатель в группе full NS через 8 и 21 д. п. и. (Рис. 7). При этом наибольший вклад в различия между группами вносили полифункциональные CD8+ Т-лимфоциты, од-новременно экспрессирующие цитокины IFNγ, IL2 и TNFα(full NS: 5.9±0.5, NS124: 10.7±1.6, p=0.0008 через 8 дней; full NS: 4.9±0.5, NS124: 7.3±0.4, p=0.0003 через 21 день). Кроме того, в группе NS124 на 8-й день отмечено формирование более высокого содержания субпопуляций CD8+ Т-лимфоцитов с фенотипом IFNγ+IL2+TNFα-и IFNγ+IL2-TNFα+ (full NS: 0.5±0.08 и 5.6±1.04, NS124: 1.5±0.5 и 8.9±2.6, p=0.008 и 0.05 соответственно). Через 21 день после иммунизации в группе NS124 происходило изменение состава популяций цитокин-продуцирующих клеток, выражающееся в увеличении доли IFNγ+IL2+TNFα+ и IFNγ+IL2-TNFα+ Т-лимфоцитов и сокращении относительного содержания IFNγ+IL2-TNFα-клеток (Рис. 7).

На графиках представлены индивидуальные значения совокупной доли цитокин-продуцирующих Т-лимфоцитов от общего числа эффекторных CD8+ Т-клеток (CD8+CD44+CD62L-), а также средние значения по каждой группе (n = 4). На круговых диаграммах представлен относительный состав популяций, продуцирующих 1, 2 или 3 цитокина одновременно. Символом * отмечены достоверные различия между группами full NS и NS124 (*: р<0.05, **: p<0.01, ***: p<0.001, t-критерий Стьюдента).
ОБСУЖДЕНИЕ
В данном исследовании было проведено сравнение врожденного и адаптивного Т-клеточного иммунного ответа на вирусы гриппа А с полноразмерным и укороченным до 124 а. к. белком NS1. Анализ продукции цитокинов воспаления в перитонеальных смывах мышей, иммунизированных штаммами А/PR8/full NS и А/PR8/NS124, показал, что укорочение белка NS1 приводит к подавлению иммуносупрессорной активности вируса гриппа, что сопровождается значительным повышением продукции IFNβ, IL6, TNFα, IL12p70, IL27, MCP1 и IL1β в ответ на иммунизацию штаммом А/PR8/NS124. Полученные данные о повышении экс-прессии цитокинов семейства IL12 (IL12p70, IL27) расширяют имеющиеся в литературе сведения о высоком цитокиногенном потенциале вирусов гриппа с укороченным белком NS1 [4, 20]. Наиболее выраженные различия между вирусами А/PR8/full NS и А/PR8/NS124 были связаны с продукцией IFNβ, которая подавляется за счет взаимодействия белка NS1 с внутриклеточным паттерн-распознающим рецептором RIG-I и другими компонентами сигнального пути, активирующего экспрессию IFN I типа [21, 22]. Поскольку продукция IFNα/β начинается на самых ранних этапах врожденного противовирусного иммунного ответа и влечет за собой активацию экспрессии множества IFN-индуцируемых генов (ISG), наблюдаемая в данной работе повышенная продукция провоспалительных цитокинов после иммунизации вирусом А/PR8/NS124 является, вероятно, следствием высокой интерфероногенности данного штамма.
Показано, что интраперитонеальное введение вирусов вызывало активную миграцию в брюшную полость моноцитов, макрофагов и нейтрофилов. Согласно литературным данным, именно эти клетки обеспечивают первую линию иммунной защиты при гриппе [23]. Резидентные макрофаги осуществляют фагоцитоз инфицированных клеток организма-хозяина, ограничивая распространение вируса [24]. Кроме того, они привлекают в очаг воспаления моноциты, дифференцирующиеся в макрофаги и дендритные клетки моноцитарного происхождения [25]. Нейтрофилы также принимают активное участие в фагоцитозе вирусных частиц и апоптотических клеток в очаге инфекции [26]. Помимо этого, им принадлежит важная роль в привлечении цитотоксических Т-лимфоцитов: согласно данным, полученным в работе Lim et al. [27], при перемещении нейтрофилы оставляют за собой хемокиновый след, содержащий преимущественно CXCL12, который направляет миграцию Т-клеток. Известно, что у мышей нейтрофилы осуществляют MHCI-зависимую презентацию вирусных антигенов, а также экспрессируют костимуляторные молекулы CD80 и CD86 [28].
Несмотря на повышенную индукцию цитокинов штаммом А/PR8/NS124, увеличение доли моноцитов, макрофагов и нейтрофилов в перитонеальных смывах быстрее происходило в ответ на иммунизацию штаммом с полноразмерным белком NS1 с последующим выравниванием показателей. Известно, что IFN I типа способны оказывать как активирующее, так и ингибирующее влияние на клетки иммунной системы в зависимости от концентрации и продолжительности воздействия [29]. Кроме того, помимо провоспалительных факторов, концентрация которых оценивалась в данной работе, IFNα/βиндуцируют экспрессию ряда противовоспалительных цитокинов, а также некоторых генов, отвечающих за индукцию апоптоза. Не исключено, что гиперпродукция IFNβ, наблюдавшаяся после введения мышам вируса А/PR8/NS124, вызвала подавление миграции нейтрофилов и моноцитов в перитонеальную полость.
В работе анализировалась динамика относительного состава различных субпопуляций дендритных клеток. Данные иммуноциты гетерогенны по своему составу, происхождению, локализации и выполняемым функциям. Согласно литературным данным, CD11b+ и CD103+ ДК мигрируют во вторичные органы иммунной системы в процессе развития иммунного ответа. В исследовании с рекомбинантным вирусом PR8, содержащим зеленый флуоресцентный белок (green fluorescent protein, GFP) в составе полноразмерного белка NS1, было установлено, что через 48 ч после иммунизации 8.5% CD103+ кДК медиастинальных лимфоузлов позитивны по GFP, тогда как среди CD11b+ кДК только 0.5% клеток содержало флуоресцентный белок, что, по мнению авторов исследования, свидетельствует о более интенсивной миграции CD103+ кДК в лимфоузлы, хотя может указывать и на различия в пермиссивности разных популяций ДК для вируса гриппа [30].
Использованная панель флуорохром-конъюгиро-ванных антител позволила идентифицировать четыре субпопуляции дендритных клеток на основании экспрессии маркеров CD11b и CD103. Анализ динамики CD11bhi ДК, CD11b-ДК и CD103+ ДК позволяет предположить, что через 24 ч после иммунизации происходит выход дендритных клеток из зоны введения вируса. При этом в группе NS124 отмечалось более выраженное сокращение содержания ДК, что может являться признаком их усиленной миграции в периферические лимфоузлы для осуществления презентации антигена наивным Т-лимфоцитам [31, 32].
Анализ экспрессии молекул CD83 и CD86 широко применяется для изучения активации клеток врожденного и приобретенного иммунитета. Известно, что повышение экспрессии данных маркеров сопряжено с созреванием АПК и презентацией антигенов [33, 34]. Показано, что через 24 ч после иммунизации экспрессия CD86 у мышей, иммунизированных штаммом А/PR8/NS124, достоверно превышала соответствующие значения в группе А/PR8/full NS. Не исключено, что данный эффект связан с отсутствием иммуносупрессорной активности у укороченного белка NS1, что позволяет АПК животных, иммунизированных вирусом А/PR8/NS124, поддерживать экспрессию CD86 на высоком уровне, в то время как у мышей, иммунизированных штаммом А/PR8/full NS, исследуемый показатель снижается на сроке 24 ч.
Данные о более высокой экспрессии цитокинов вирусом гриппа с укороченным белком NS1, а также о его способности стимулировать экспрессию CD86 позволяют предположить, что иммунизация вирусом А/PR8/NS124 может приводить к развитию более выраженного адаптивного CD8+ Т-клеточного иммунного ответа на антигены вируса гриппа. Результаты экспериментов показали, что иммунизация штаммом А/PR8/NS124 индуцирует формирование большего числа вирус-специфических CD8+ Т-лимфоцитов. Среди данных клеток преобладают полифункциональные CD8+-эффекторы (FNγ+IL2+TNFα+ и IFNγ+IL2-TNFα+), для которых была показана важная роль в формировании протективного противовирусного иммунного ответа [35].
Таким образом, на основании полученных данных можно заключить, что укорочение белка NS1 приводит к повышению иммуногенности вируса гриппа, что способствует более эффективной презентации вирусных антигенов за счет интенсификации миграции дендритных клеток, а также повышения уровня экспрессии костимуляторного фактора CD86, что, в свою очередь, ведет к формированию более выраженного адаптивного Т-клеточного иммунного ответа, сопровождающегося формированием по-лифункциональных эффекторных Т-лимфоцитов. Полученные результаты являются теоретическим обоснованием использования вирусов с укороченным белком NS1 в качестве живых аттенуированных гриппозных вакцин и векторов.
