ВВЕДЕНИЕ
Увеличение числа штаммов микроорганизмов, резистентных к противомикробным препаратам, широко распространено по всему миру и является серьезной проблемой современного здравоохранения и ветеринарии [1]. Пациенты, инфицированные устойчивыми к противомикробным препаратам штаммами, имеют более высокий риск летального исхода, чем пациенты с инфекциями, вызванными нерезистентными штаммами микроорганизма того же вида [2]. Совершенствование и создание новых противомикробных синтетических препаратов является одной из главных задач современной фармацевтической науки [2, 3].
В научных исследованиях по поиску новых синтетических противомикробных препаратов отмечается интерес к производным нифуроксазида. Так, в статье Rollas et al. [4] приводится обзор достаточно большого числа соединений, структурно похожих на нифуроксазид, с различными заместителями в пара- и орто-положениях бензольного кольца, большинство из которых проявляют высокую фармакологическую активность, сравнимую с современными препаратами фторхинолонового ряда. В обзоре Thota et al. [5] приведены примеры производных нитрофурана, которые применяются в качестве антибактериальных средств (Рис. 1). Авторы этого обзора делают вывод о перспективности разработки новых лекарственных препаратов на основе ацилгидразонов, к которым относятся замещенные аналоги нифуроксазида.
Tavares et al. [6] описали синтез и изучение антибактериальной активности изостеров нифуроксазида по отношению к Staphylococcus aureus (S. aureus). По данным Masunari et al. [7], новые соединения ряда нифуроксазида обладали активностью против мультирезистентного S. aureus. В этих исследованиях некоторые тиофеновые аналоги нифуроксазида проявили более высокую антибактериальную активность, чем сам нифуроксазид. Нифуроксазид и его аналоги также проявляли значительную активность по отношению к паразитам Trypanosoma cruzi [8, 9] и Leishmania donovani [10]. По данным Rando et al. [10], тиофеновые аналоги нифуроксазида значительно более активны по отношению к паразиту Leishmania donovani, чем соответствующие фурановые производные.
Нитрофураны активны в отношении многих грам-положительных и грамотрицательных микроорганизмов, некоторых видов грибов и простейших. В зависимости от концентрации эти вещества обладают бактериостатическим или бактерицидным действием [11]. Одним из главных достоинств нитрофуранов является медленное формирование устойчивости микроорганизмов к данному классу соединений [12].
Несмотря на то, что несколько соединений ряда нитрофурана применяются в качестве лекарственных препаратов в различных странах, механизм действия этих соединений детально не изучен. Считается, что при восстановлении этих веществ соответствующими ферментами в бактериях образуются очень активные интермедиаты, которые разрушают ДНК, РНК и другие макромолекулы, а также нарушают ряд жизненно важных процессов, таких как формирование клеточной стенки или синтез белков [13]. Возможно, что именно широкий спектр антимикробной активности этих соединений является причиной отсутствия выраженной бактериальной резистенции к этим препаратам.
В последнее время в научной литературе также активно обсуждается возможность применения соединений нитрофуранового ряда в качестве антираковых препаратов. Так, несколько публикаций посвящено изучению ингибирующего действия нифуроксазида на рост раковых клеток и опухолей [14-17].
Целью данного исследования был поиск нового эффективного синтетического противомикробного средства группы нитрофуранов. Основываясь на литературных данных, было решено синтезировать изостеры нифуроксазида, содержащие диметилами-но-группу, а также его тиофеновые аналоги и иссле-довать противомикробную активность полученных соединений.
МАТЕРИАЛЫ И МЕТОДЫ
Синтез соединений
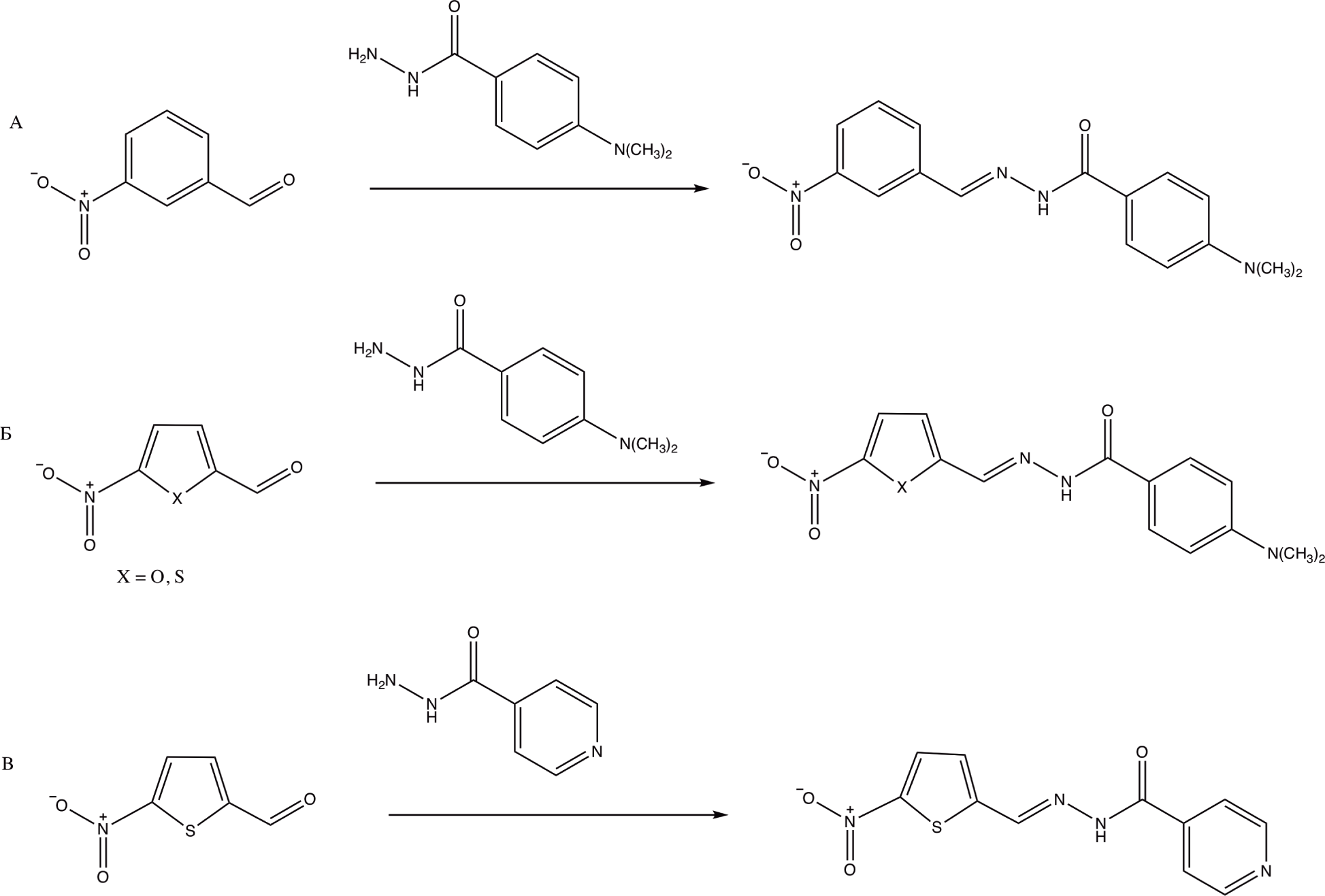
Ацилгидразоны были синтезированы методом кон-денсации гидразидов с нитро-производными арома-тических альдегидов по модифицированной методике [10] (Рис. 4). В круглодонную колбу объемом 500 мл вносили соответствующий ароматический альдегид и растворяли его в этаноле при нагревании до 50℃ и перемешивании. После растворения к смеси порциями в течение 30 мин добавляли эквимолярное количество гидразида и продолжали перемешивать еще 10 мин, проводя контроль прохождения реакции с помощью тонкослойной хроматографии (ТСХ). После окончания реакции смесь выливали в холодную воду, а полученный продукт кристаллизовали из воды.
Подтверждение структуры и чистоты соединений
Полученные соединения были проанализированы с помощью ЯМР, ИК спектроскопии и массспектрометрии. Чистоту всех синтезированных веществ определяли с помощью методов ТСХ и LCMS (liquid chromatography – mass-spectrometry) (Schimadzu Analytical HPLC LC10Avp, SPD-10A, autosampler Gilson 215, ELSD Sedex 75, Mass analyzer PE SCIEX API 165, Япония). Результаты ЯМР (HTLab AG Avance III, Швейцария) и ИК спектроскопии (HTLab AG MPA, Швейцария) подтвердили структуру полученных соединений, а данные ТСХ и LC-MS показали их высокую чистоту. Спектральные данные, а также результаты ТСХ и LC-MS представлены ниже.
5-Нитро-2-фуранкарбоксальдегид p-диметиламинобензоил гидразон (фурановый аналог) – яркооранжевый порошок, плохо растворимый в этаноле, почти нерастворимый в воде. Выход 91%. ТСХ (этанол: гексан 1:5, Rf = 0.6). 1H NMR (400 MHz, DMSO-d6) δ (ppm): 11.94 (s, 1H), 8.39 (s, 1H), 7.82 (d, J=8.14 Hz, 2H), 7.79 (d, J=4.42 Hz, 1H), 7.21 (d, J=4.42 Hz, 1H), 6.77 (d, J=8.14 Hz, 2H), 3.00 (s, 6H). ИК (KBr) ν (см-1): 3417 (NH), 1529 (C=O), 1354 (NO2). LC-MS, вода/ацетонитрил/трифторусксусная кислота: 7.01 мин, (m/z): 303.4 (M+1).
3-Нитробензальдегид p-диметиламинобензоил гидразон (бензоидный аналог) – порошок желтого цвета, растворим в горячем этаноле, почти нерастворим в воде, плохо растворим в диоксане. Выход 92%. ТСХ (этанол: гексан 1:5, Rf = 0.4). 1H NMR (300 MHz, DMSO-d6) δ (ppm): 11.60 (br s, 1H), 8.53 (s, 2H), 8.25 (d, J=8.5 Hz, 1H), 8.14 (d, J=7.5 Hz, 1H), 7.83 (d, J=8.2 Hz, 2H), 7.75 (m, 1H), 6.75 (d, J=8.2 Hz, 2H), 3.00 (s, 6H). 13C NMR (75.5 MHz, DMSO-d6) δ(ppm): 163.2, 153.6, 148.3, 143.5, 136.7, 133.2, 130.4, 129.4, 123.9, 120.6, 119.1, 110.9, 39.6. ИК (KBr) ν (см-1): 3039 (CH), 1628 (C=O), 1352 (NO2). LC-MS: 7.32 мин., (m/z): 313.3 (M+1).
5-Нитро-2-тиофенкарбоксальдегид p-диметил-аминобензоил гидразон (тиофеновый аналог) – кри-сталлический порошок ярко-красного цвета, хорошо растворим в горячем этаноле, плохо растворим в воде, гексане. Выход 87%. ТСХ (этанол: гексан 1:5, Rf = 0.5). 1H NMR (400 MHz, DMSO-d6) δ (ppm): 11.90 (br s, 1H), 9.62 (s, 1H), 8.11 (d, J=5.43 Hz, 1H), 7.81 (d, J=7.84 Hz, 2H), 7.51 (d, J=5.43 Hz, 1H), 6.26 (d, J=7.84 Hz, 2H), 3.00 (s, 6H). 13C NMR (75.5 MHz, DMSO-d6) δ (ppm): 163.3, 152.7, 150.4, 147.5, 139.3, 130.6, 129.5, 128.9, 118.7, 110.8, 39.58. ИК (KBr) ν (см-1): 3052 (CH), 1342 (NO2), 603/682 (C – S). LC-MS: 7.37 мин., (m/z): 319.3 (M+1).
5-Нитро-2-тиофенкарбоксальдегид изоникотиноил гидразон (пиридиновый аналог) – порошок зе-лено-желтого цвета, хорошо растворимый в горячем этаноле, плохо растворим в воде, гексане. Выход 91%. ТСХ (этанол: гексан 1:5, Rf = 0.8). 1H NMR (400 MHz, DMSO-d6) δ (ppm): 12.5 (s, 1H), 8.8 (d, 2H), 8.7 (s, 1H), 8.3 (d, 1H), 7.8 (d, 2H), 7.6 (d, 1H). ИК (KBr) ν (см-1): 3392 (NH), 1652 (C=N), 583/672 (C – S). LC-MS: 5.72 мин., (m/z): 277.3 (M+1).
Используемые культуры
В качестве тест-культур использовали штаммы наиболее распространенных возбудителей инфекционных заболеваний и внутрибольничных инфекций [18]. Использовали штаммы Escherihia coli №241 (E. coli), S. aureus №906, Stafilococcus haemolyticus №209 (S. haemolyticus), Pseudomonas aeruginosa № 27853 (P. aeruginosa), Candida albicans №927 (C. albicans) и Cryptococcus neoformans №3465 (Cr. neofomans), полученные из Центра коллективного пользования, Коллекция НИИВС им. И. И. Мечникова.
Оценка антимикробной активности препаратов
Для оценки антимикробной активности использовали метод диффузии в агар; активность соединений определяли путем сравнения размеров зон ингиби-рования роста бактерий по описанной ранее методике [19, 20]. Поскольку исследуемые вещества плохо растворялись в воде и диффундировали в агар, метод модифицировали, увеличив концентрацию препаратов до 2 мг/мл (в отличие от 1 мг/мл, предлагаемого фармакопеей). Для получения нужной концентрации предварительно растворяли 0.1 г исследуемых образцов в 1.3 мл 37% HCl с последующим добавлением 50 мл H2O и нагреванием. Так как все исследованные соединения обладали основными центрами, которые протонировались в кислой среде, pH конечных рас-творов приближался к физиологическому. В качестве препарата сравнения использовали коммерческое лекарственное средство Энтерофурил (Bosnalijek, Босния и Герцеговина) в капсулах, содержащих 200 мг нифуроксазида. С целью определения пороговой чув-ствительности были оценены активности растворов в разведениях в 2, 4 и 8 раз. Разведение образцов про-водили в физиологическом растворе.
Для оценки чувствительности бактерий использовали агар Мюллера-Хинтона (MХА) в соответствии с методикой, описанной ранее [21]. Для приготовления инокулята колонии бактерий суспендировали в стерильном изотоническом растворе до плотности 0.5 по стандарту мутности МакФарланда. Инокулят наносили на чашки с МХА и равномерно распределяли с помощью микробиологического шпателя Дригальского. Стерильным пробойником делали лунки диаметром 10 мм с последующим внесением в них 100 мкл растворов исследуемых веществ. На каждой чашке было проделано 4 лунки, концентрация в первой лунке составляла 2 мг/мл, в последней – 0.25 мг/мл для каждого из 5 исследуемых веществ. После внесения образцов в агар, содержащий культуру бактерий, чашки Петри инкубировали в термостате при температуре 37℃ в течение суток. После инкубации результат эксперимента определяли путем измерения диаметров зон ингибирования роста бактерий.
Определение противогрибковой активности препаратов по отношению к штаммам C. albicans и Cr. neoformans, выращенным на глюкозо-пептонно-дрожжевой среде при 25℃ в течение 19 ч, проводили методом последовательных разведений в круглодонном 96-луночном планшете (Медполимер, Россия) (Рис. 5) [22-24]. Планшет был поделен на 2 части. В верхней части испытывали активность по отношению к C. albicans, в нижней части – по отношению к Cr. neoformans. Каждая часть состояла из пяти рядов для исследования активности каждого из пяти веществ. Шестой ряд служил контролем. Препараты, растворенные в диметилсульфоксиде (ДМСО), вносили в первую лунку ряда в объеме 10 мкл и далее осуществляли двукратные серийные разведения. Контролем служил ДМСО, разведенный аналогичным образом. Концентрация препарата в первой ячейке составляла 1024 мкг/мл, а в последней – 8 мкг/ мл. Затем в каждую лунку вносили 190 мкл суспензии клеток культуры дрожжей в синтетической питательной среде с конечной концентрацией клеток 103 колониеобразующих единиц (КОЕ/мл), содержащей рН-индикатор бромкрезоловый синий (рН среды 5.5, цвет индикатора – голубой). Изменение цвета индикатора с голубого на желтый указывает на изменение pH среды культивирования, что свидетельствует о росте данных штаммов и об отсутствии активности испытуемых образцов. В эксперименте была использована синтетическая питательная среда, приготовленная по методике Yarrow [25]. Перемешивание осуществляли в момент внесения большего объема среды в меньший объем препарата. Инкубацию проводили в стационарном режиме при 32℃. Результаты учитывали визуально через 48 ч инкубации.
Статистическая обработка данных
Эксперименты по определению антимикробной и антигрибковой активности проводили 3 раза и рас-считывали средние значения. Все данные были под-вергнуты статистическому анализу. Результаты об-рабатывали с помощью стандартного программного пакета Microsoft Excel для Windows. Данные представ-ляли как среднее (М) ± квадратичное отклонение (SD).
РЕЗУЛЬТАТЫ
Синтез веществ и проверка их чистоты
При выполнении исследования исходили из предположения о возможности получения более эффективного изостера существующего лекарственного средства путем направленной модификации его структуры с сохранением фармакофора.
После изучения структуры активных нитрофуранов был выделен фармакологически значимый фрагмент – 2-иминометил-5-нитрофуран (Рис. 2).
За основную идею было принято предположение, что структура, необходимая для проявления антибактериальной активности, должна содержать нитрогруппу в пятом положении и иминометильную группу во втором положении фуранового кольца, что создает огромное разнообразие изостеров как бензоидного, так и гетероциклического ряда с различными группировками в боковой цепи. Структуры основных объектов исследования представлены на Рис. 3.
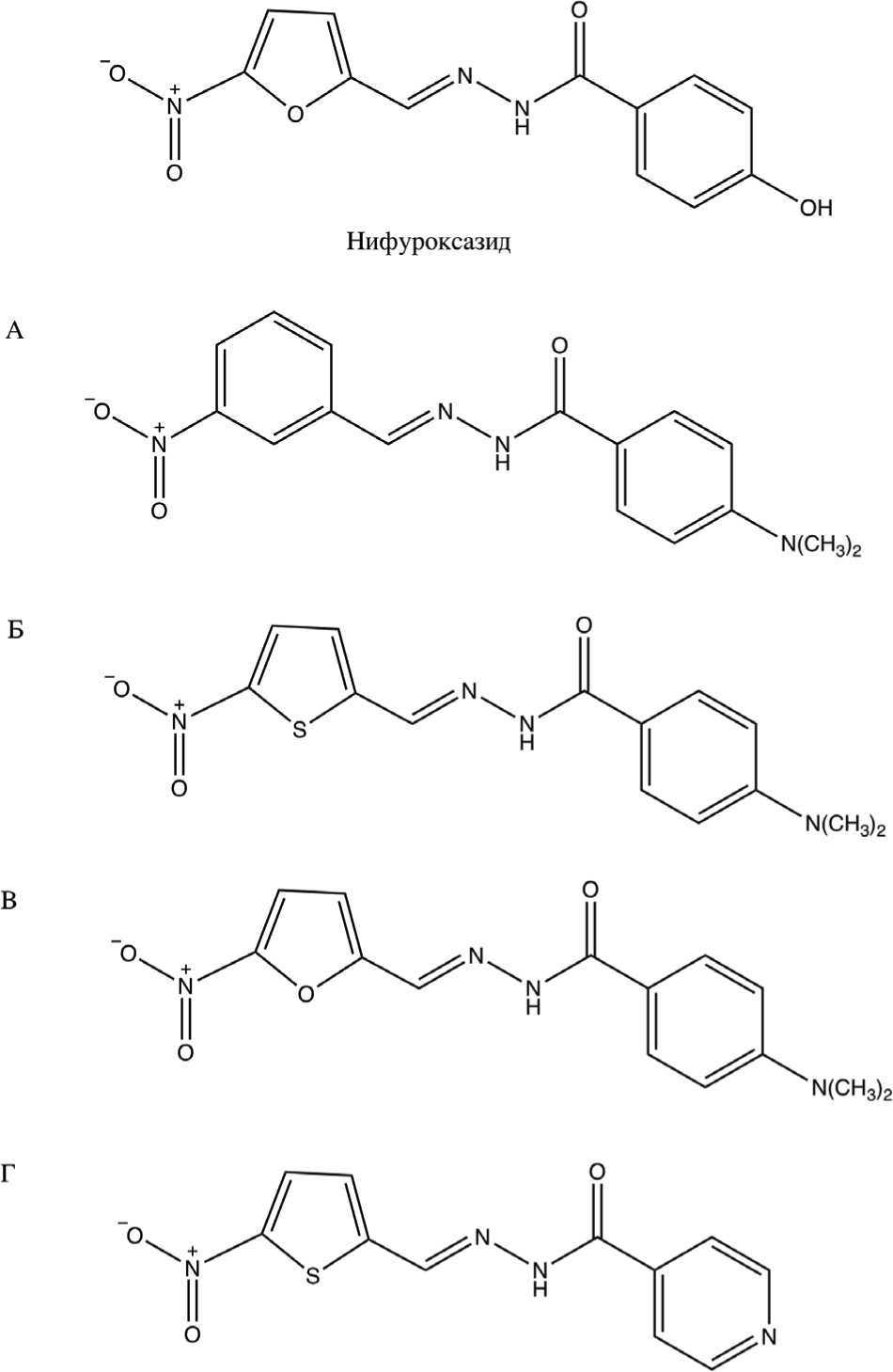
Схемы синтеза производных нифуроксазида приведены на Рис. 4. Реакции проводились в этаноле при кипячении.
Результаты ЯМР и ИК спектроскопии подтвердили структуру полученных соединений, а данные ТСХ и LC-MS показали их высокую чистоту. Данные анализа представлены в разделе «Материалы и методы».
Ингибирующая активность соединений в отношении бактерий и дрожжевых грибов
Результаты измерения зон ингибирования роста бактерий для всех образцов на тест-культурах бактерий представлены в Таблице 1. Положительным контролем служил коммерческий лекарственный препарат Энтерофурил. Определение зон ингибирования роста бактерий показало, что контрольный препарат Энтерофурил подавлял рост S. aureus, S. haemolyticus и P. aeruginosa в концентрации 2.0 мг/мл и не подавлял рост этих микроорганизмов в меньших концентрациях (1.0 и 0.5 мг/мл). Ни в одной из использованных концентраций Энтерофурил не подавлял роста E. сoli. В работе использовали штамм E. сoli № 241, не относящийся к энтеропатогенной группе, что не исключает чувствительности других штаммов, в том числе патогенных групп, к действию Энтерофурила. Аналогичные результаты были получены для аналогов 1, 2 и 3. В отличие от Энтерофурила и аналогов 1, 2 и 3, пиридиновый аналог (аналог 4) ингибировал рост S. aureus не только в концентрации 2.0 мг/мл, но и в концентрациях 1.0 и 0.5 мг/мл. Ингибирующая активность аналога 4 в отношении P. aeruginosa, S. haemolyticus и E. coli не отличалась от активности остальных веществ.
| Производные нифуроксазида, используемая концентрация (мг/мл) | Диаметр зон ингибирования роста тест-культур (мм) | |||
|---|---|---|---|---|
| S.aureus | S.haemolyticus | P.aeruginosa | E.coli | |
| 1. Бензоидный аналог (аналог 1) | ||||
| 2 мг/мл | 15.5±0.5 | 17.5±0.5 | 14.0±0.5 | 0 |
| 1 мг/мл | 0 | 0 | 0 | 0 |
| 0.5 мг/мл | 0 | 0 | 0 | 0 |
| 2. Тиофеновый аналог (аналог 2) | ||||
| 2 мг/мл | 15.3±0.6 | 20.0±0 0 | 18.3±0.3 | 0 |
| 1 мг/мл | 0 | 0 | 0 | 0 |
| 0.5 мг/мл | 0 | 0 | 0 | 0 |
| 3. Фурановый аналог (аналог 3) | ||||
| 2 мг/мл | 18.5±0.5 | 22.3±0.6 | 16.0±0 | 0 |
| 1 мг/мл | 0 | 0 | 0 | 0 |
| 0.5 мг/мл | 0 | 0 | 0 | 0 |
| 4. Пиридиновый аналог (аналог 4) | ||||
| 2 мг/мл | 25.3±0.6 | 27.8±0.3 | 18.0±0 | 0 |
| 1 мг/мл | 18.3±0.3 | 0 | 0 | 0 |
| 0.5 мг/мл | 16±0 | 0 | 0 | 0 |
| 5. Энтерофурил | ||||
| 2 мг/мл | 19.7±0.3 | 21.2±0.3 | 21.5±0.5 | 0 |
| 1 мг/мл | 0 | 0 | 0 | 0 |
| 0.5 мг/мл | 0 | 0 | 0 | 0 |
Результаты изучения ингибирующей активности полученных соединений в отношении C. albicans и Cr. neoformans представлены на Рис. 5. За 48 ч инкубации индикатор изменил цвет с голубого на желтый в контрольных лунках с раствором ДМСО и во всех лунках с испытуемыми образцами, что свидетельствует о закислении среды продуктами метаболизма дрожжей, т. е. об их беспрепятственном росте. Следовательно, ни один из исследованных образцов, так же как и контрольный препарат Энтерофурил, не был активен в отношении C. albicans и Cr. neoformans в указанном диапазоне концентраций.

ОБСУЖДЕНИЕ
Противомикробная активность полученных четырех аналогов нифуроксазида была изучена по отношению к штаммам S. aureus, S. haemolyticus, P. aeruginosa, E. сoli, а также к клинически значимым видам дрожжей C. albicans и Cr. neoformans. Изучение противомикробной активности полученных соединений показало, что при концентрации 2.0 мг/мл все исследуемые препараты проявляли активность в отношении штаммов S. aureus, S. haemolyticus, P. aeruginosa. Лишь пиридиновый аналог (аналог 4) ингибировал рост штамма S. aureus также при концентрациях 1.0 и 0.5 мг/мл. Ни один из исследованных препаратов не оказывал ингибирующего воздействия на штамм E. coli. Также ни один из испытуемых образцов не был активен в отношении дрожжей C. albicans и Cr. neoformans в рассмотренном диапазоне концентраций.
Анализ данных по антибактериальной активности изученных соединений позволяет сделать вывод, что замена пятичленного гетероароматического кольца на шестичленное бензольное привела к заметному уменьшению противомикробной активности, при этом все фурановые и тиофеновые изостеры ингибировали рост микроорганизмов не менее выражено, чем стандарт (нифуроксазид). Этот результат, вероятно, свидетельствует о принципиальной важности наличия пятичленной π-избыточной ароматической системы в структуре данных образцов. Переход от фуранового кольца к тиофеновому при наличии объемного заместителя в боковой цепи (диметиламиногруппы) незначительно повлиял на противомикробную активность, при этом фурановые и тиофеновые изостеры мало отличались по степени ингибирования роста микроорганизмов от стандарта (нифуроксазида). Наибольший интерес представляет аналог 4 – пи-ридиновый нифуроксазид, в котором совмещены тио-феновое кольцо, пиридиновый фрагмент и отсутствие крупного заместителя в боковой цепи. Этот препарат превзошёл по активности стандарт (нифуроксазид).
При изучении различных замещенных в ряду ге-тероциклических соединений одного класса обычно удается найти зависимость антибактериальной активности препаратов от их структуры и распределения электронной плотности в молекуле. В случае производных нифуроксазида анализ литературных данных и полученных нами результатов не позволил сделать конкретных выводов в этом отношении.
Согласно современным представлениям о механизме действия нифуроксазида и его аналогов, активная форма лекарственного препарата образуется в результате восстановления вещества соответствующими ферментами в бактериях [13]. Исходя из этого, логично предположить, что активность аналогов нифуроксазида зависит от их редокс-потенциала и, соответственно, от наличия электронно-донорных или электронно-акцепторных заместителей в молекуле. Действительно, по данным Masunari и Tavares [7], введение электронно-акцепторных заместителей в пара-положение бензольного кольца тиофеновых аналогов нифуроксазида приводит к повышению активности препаратов по отношению к S. aureus, а введение электронно-донорных заместителей соответственно понижает активность аналогов. Однако это противоречит данным Rando et al. [26], изучавших действие этих соединений на Mycobacterium tuberculosis и показавших, что препараты с донорными заместителями проявляют значительно большую активность, чем соответствующий галогенсодержащий аналог, по отношению к этому штамму бактерий. Данное предположение также не подтверждается результатами, полученными Popiolek и Biernasiuk [27] и Zorzi et al. [28], которые изучали активность фурановых аналогов нифуроксазида. Согласно данным этих авторов, биологическая активность препаратов по отношению к S. aureus не зависит от введения электронно-донорных или электронно-акцепторных заместителей в пара-положение бензольного кольца. Отсутствие такой зависимости подтверждается также результатами Paula et al. [29], которые определили редокс-потенциалы фурановых и тиофеновых аналогов нифуроксазида. Эти авторы пришли к выводу, что введение различных заместителей в молекулу очень слабо влияет на редокс-потенциал, а редокспотенциалы замещенных фуранового и тиофенового рядов различаются незначительно. Их выводы могут служить объяснением противоположных результатов, полученных в работах Tavares et al. [30] и Alsaeedi et al. [31] при сравнении активности замещенных фуранового и тиофенового рядов по отношению к различным штаммам бактерий.
Изучение активности синтезированных соединений по отношению к клинически значимым видам дрожжей C. albicans № 927 и Cr. neoformans № 3465 показало, что как полученные нами четыре аналога нифуроксазида, так и стандарт – Энтерофурил, – не оказывали ингибирующего действия на рост этих дрожжей в изученном диапазоне концентраций. Это соответствует литературным данным. Так, Popiolek и Biernasiuk [27] показали, что замена окси-группы в молекуле нифуроксазида на такие заместители, как галоген, метокси-группа, аминогруппа или димети-ламино-группа, не приводила к появлению активности по отношению к C. albicans ATTC 10231. Единственный описанный ими ароматический аналог нифуроксазида, проявивший весьма слабую активность к этим дрожжам, содержал фрагмент гидразида никотиновой кислоты. Из двадцати двух ароматических аналогов нифуроксазида, изученных Zorzi et al. [28], лишь половина соединений проявила весьма слабую активность по отношению к C. albicans ATCC 537Y.
Поскольку на основании известных в настоящее время данных не удается определить зависимость антимикробной активности от структуры молекулы, поиск новых активных соединений в ряду аналогов нифуроксазида является весьма нетривиальной задачей. В этих условиях обнаружение нами нового активного соединения – пиридинового аналога нифуроксазида – представляет значительный интерес с точки зрения разработки новых гетероциклических антимикробных препаратов – производных фурана и тиофена.



