ВВЕДЕНИЕ
К числу вирусов, наиболее часто поражающих респираторный тракт человека, относятся такие РНК-содержащие вирусы, как респираторно-синцитиальный вирус (РСВ), риновирусы, вирусы гриппа и коронавирусы (CoV). РСВ вызывает наиболее тяжелую патологию в легких (бронхиолит), особенно у детей первого года жизни, с высокими показателями летальности [1]. Бронхиолит, вызванный РСВ и риновирусом, также связан с повышенным риском развития астмы [2]. Регулярные эпидемии, вызываемые вирусами гриппа, ежегодно приводят к 250 000–500 000 смертельных случаев во всем мире [3, 4]. Коронавирусы до 2020 г. вызывали сезонные заболевания, за исключением зоонозов, вызванных вирусами острого респираторного синдрома (severe acute respiratory syndrome, SARS-CoV-1) и ближневосточного респираторного синдрома (Middle East respiratory syndrome, MERS), а в марте 2020 г. была объявлена первая пандемия, вызванная вирусом SARS-CoV-2. Заболевание, названное COVID-19, по состоянию на март 2022 г. привело к гибели более 6 млн человек во всем мире [5, 6].
Вирусы распознаются эпителиальными клетками респираторного тракта, экспрессирующими рецепторы распознавания образов (pattern-recognition receptors, PRRs), основными из которых для РНКсодержащих вирусов являются толл-подобные рецепторы (toll-like receptors, TLRs) 3, 7, 8 и цитозольные RIG-подобные и NOD-подобные рецепторы. Проникая в клетку, вирус запускает реакции врожденного иммунного ответа, сопровождающиеся массивным выбросом провоспалительных цитокинов, направленных на подавление вирусной репликации [7]. Выработка интерферонов (IFN) I (α, β) и III (λ) типов вызывает защиту соседних неинфицированных эпителиальных клеток от внедрения вирусов. Если быстро подавить репродукцию вируса не удается, иммунные клетки продуцируют провоспалительные цитокины (IL6, TNFα), способствуя привлечению в респираторный тракт нейтрофилов и Т-клеток, что приводит к развитию воспаления [8, 9, 10].
На сегодняшний день самую большую угрозу представляет COVID-19, для которого выделено 5 фаз, включающих инкубационный период, фазу развития симптомов, фазу раннего воспаления, фазу вторичной инфекции и фазу мультисистемного воспаления (multisystem inflammation syndrome, MIS) [11]. Инкубационный период может длиться от 2 до 14 дней. Наличие у пациента активного врожденного иммунитета приводит к быстрой элиминации вируса и бессимптомной форме заболевания, которое встречается в 40–45% случаев [12, 13]. При менее эффективном иммунном ответе появляются симптомы, включающие лихорадку, кашель, боль в мышцах, потерю обоняния, желудочно-кишечные симптомы. На этой стадии раннего воспаления возможно лечение противовирусными препаратами прямого действия. Повышение тяжести COVID-19 чаще наблюдается у пожилых пациентов и лиц с сопутствующими заболеваниями, у которых несбалансированный иммунный ответ с низким уровнем продукции IFN I типа и избыточной продукцией IL6 и TNFαпрепятствует быстрой элиминации вируса [14-16]. У больного может развиться гипоксемия, легочная патология, сердечная дисфункция, почечная недостаточность, неврологические проявления или полиорганная недостаточность [17, 18]. Ранее эту стадию называли цитокиновым штормом. На этой стадии возможно ослабление избыточного воспалительного ответа с помощью дексаметазона или препаратов, подавляющих IL6 (моноклональные антитела к рецептору IL6, например тоцилизумаб) [19].
При отсутствии лечения COVID-19 может перейти в фазу вторичной бактериальной или грибковой инфекции,требующую применения антибактериальных и противогрибковых препаратов. Частым исходом при COVID-19 является организующаяся вторичная пневмония с поражением бронхиол и альвеол, также характерная для для РСВ инфекции и гриппа [20].
При неблагоприятном развитии COVID-19 может наступить MIS [21]. На этой фазе чрезмерные дисфункциональные реакции препятствуют элиминации вируса и приводят к тяжелым последствиям, включая васкулит, тромбоэмболические процессы, иммуноопосредованную тромбоцитопению [22-24]. Уровень IL6 на этой стадии может быть в 10–200 раз выше, чем на стадии раннего воспаления [25].
При тяжелом течении COVID-19 ведущую роль играет IFNγ, который, взаимодействуя с рецепторами IFNγ, управляет клеточным иммунным ответом на инфекцию, активируя макрофаги и усиливая презентацию антигена и дифференциацию Т-клеток [26, 27]. Через JAK/STAT сигналинг IFNγ может также напрямую передавать сигналы эпителиальным клеткам, вызывая экспрессию хемокинов [28]. Один из основных хемокинов при тяжелых инфекциях дыхательных путей – IFNγ-индуцируемый белок 10 (CXCL10) [29], повышение уровня которого в плазме и бронхоальвеолярном лаваже (БАЛ) больных коррелирует с тяжестью заболевания [29, 30]. В сыворотках больных также обнаруживаются CXCL2, IL8 и CXCL9 [31]. Высокий уровень воспалительных цитокинов приводит к гибели клеток, острому повреждению тканей и органов, аномальному изменению сосудистого гемостаза и в итоге – к полиорганной недостаточности [32]. Ингибирование отдельных ветвей иммунного ответа может ограничить разрушающий эффект воспаления [33]. Независимо от сроков начала терапии противовирусными средствами прямого действия, на всех этапах инфекционного процесса необходимо воздействовать на вирус-индуцированное воспаление при развивающейся патологии легких и поражении сосудистой сети респираторного тракта.
Препарат ХС221GI изначально разрабатывался как средство для лечения РСВ инфекции у пациентов с иммуносупрессией и детей. При скрининге серии новых химических соединений в модели РСВ инфекции на хлопковых крысах (рекомендуемой модели для изучения РСВ инфекции) XC221GI проявил наиболее высокую эффективность. В данной работе мы представили результаты исследования фармакодинамической активности XC221GI при респираторной вирусной инфекции с целью изучения возможности его использования в качестве средства упреждающей противовоспалительной терапии при РСВ инфекции и COVID-19. Мы показали эффективность ХС221GI в экспериментах РСВ инфекции in vitro в перевиваемой эпителиальной клеточной культуре A549 и in vivo у хлопковых крыс. Кроме того, продемонстрировали эффект XC221GI на индукцию в легких мышей хемокинов CXCL10, CXCL9 и CXCL11 и приток нейтрофилов в модели воспаления, вызванного интраназальным (i.n.) введением животным IFNγ.
МАТЕРИАЛЫ И МЕТОДЫ
Препарат
По номенклатуре IUPAC, XC221GI представляет собой (1-[2-(1-метилимидазол-4-ил)-этил] пергидроазин2,6-дион) с молекулярной массой 221.3 г/моль. Субстанция XC221GI была произведена и выпущена компанией Alven Laboratories s.r.o (Чехия) в соответствии с действующими европейскими нормами надлежащей производственной практики (Good Manufacturing Practice).
Эффект ХС221GI на синтез IL6 и IL8 при РСВ инфекции
Перевиваемую культуру клеток карциномы легкого человека (линия А549, АТСС) культивировали в среде DMEM/F-12 (Gibco, США), содержащей 2% глутамина и 10% эмбриональной бычьей сыворотки, при 37℃, в атмосфере 5% СО2 при относительной влажности 95%. РСВ человека (штамм А2, Influenza Reagent Resource, IRR, США) культивировали в перевиваемой эпителиальной клеточной культуре МА-104. Эксперимент проводили в клеточной культуре A549 в бессы-вороточной среде DMEM/F-12. Для анализа использовали вируссодержащую жидкость.
В лунки с отмытым от культуральной среды монослоем клеток А549 добавляли XC221GI в концентрациях 0.001 мкг/мл, 0.01 мкг/мл, 0.1 мкг/мл, 1 мкг/мл и 3 мкг/мл. Одновременно вносили РСВ с множественностью заражения (multiplicity of infection, MOI) 0.01. Общий объем доводили культуральной средой до 500 мкл/лунку. Повторно препарат добавляли через 24 ч. Для разведения субстанции и вируса использовали бессывороточную среду DMEM-F12 с добавлением 2% культуральной добавки Gluta-Max (Gibco, США). Контролем репродукции вируса служили лунки с клетками, инфицированными РСВ, без добавления XC221GI. Отрицательным контролем служили лунки с неинфицированными клетками с добавлением субстанции в те же сроки. Планшеты инкубировали в СО2-инкубаторе при 37℃. Через 48 ч после инфицирования культуральную среду из лунок отбирали и проводили количественную оценку синтеза IL6 и IL8 с использованием коммерческих ELISA тестсистем Human IL6 и Human IL8/NAP-1 Platinum ELISA (eBioscience, США).
Цитотоксический эффект XC221GI оценивали при помощи колориметрического микротетразолиевого теста с использованием 3-(4,5-Dimethyl-2-thiazolyl)2,5-diphenyl-2H-tetrazolium bromide (МТТ). Для определения токсического влияния ХC221GI вносили в планшеты с клетками А549 в концентрации 0.005– 5000 мкг/мл и инкубировали в течение 48 ч при 37℃, 5% СО2 и относительной влажности 95% с повторным добавлением через 24 ч.
Эффект XC221GI на легочную патологию при РСВ инфекции у хлопковых крыс
Животные
Эксперименты были выполнены в компании Sigmovir Biosystems, Inc. (Rockville, США). Самки хлопковых крыс (Sigmodon hispidus) (возраст от 6 до 8 недель, масса тела 70–100 г) были получены из колонии Sigmovir Biosystems, Inc. Животных содержали в больших поликарбонатных клетках и обеспечивали стандартным кормом для грызунов и водой по потребности. Хлопковые крысы, используемые в эксперименте, были серонегативными в отношении посторонних респираторных вирусов и других распространенных патогенов грызунов. Все эксперименты проводили с ис-пользованием протоколов, одобренных Комитетом по уходу и использованию животных Университета Мэриленда (Institutional Animal Care and Use Committee, IACUC). Всем животным на ухо прикрепляли бирки c идентификационным номером. После инфицирования РСВ животных содержали индивидуально.
Инфицирование животных
Каждое животное перед заражением получало легкий наркоз (ингаляция изофлюрана). РСВ хлопковым крысам вводили i.n пипеткой в дозе 5x105 бляшкообразующих единиц (БОЕ).
Оценка патологии
В первом исследовании животные были разделены на группы по 5 особей. Хлопковые крысы, инфицированные РСВ, через 24 ч после заражения в течение 5 суток получали ХС221GI (20 мг/кг/сут) перорально (p.o.) с питьевой водой. Животные контрольной группы были инфицированы РСВ и получали питьевую воду без добавления ХС221GI; животные интактной группы вместо РСВ получали фосфатный буфер (phosphate buffered saline, PBS) и питьевую воду без препарата. На 6-е сутки после инфицирования животных умерщвляли, изымали легкие и готовили гистологические срезы, которые окрашивали гематоксилин-эозином (H&E). Оценивали 2 параметра легочной патологии, включающие интерстициальную пневмонию (воспалительная клеточная инфильтрация и утолщение альвеолярных стенок) и альвеолит (клетки в альвеолярных пространствах). Слайды оценивали вслепую по шкале тяжести в баллах от 0 до 4, принятую в Sigmovir Biosystems, Inc. [34]. Полуколичественная гистологическая система оценки воспаления включала количество интерстициальных и альвеолярных инфильтратов: 0% – 0 баллов, 0–25% – 1 балл, 25–50% – 2 балла, 50–75% – 3 балла, >75% – 4 балла. Баллы, полученные при оценке двух показателей, суммировали [35]. Эффект XC221GI оценивали при сравнении группы леченых животных с группой контроля, получавшей воду вместо препарата.
Во втором эксперименте использовали хлопковых крыс c экспериментальной иммуносупрессией, вызванной введением циклофосфамида (cyclophosphamide, CY). CY вводили в дозе 50 мг/кг в течение 3 недель, перед инфицированием доза была снижена до 37.5 мг/кг и до 25 мг/кг в день и после инфицирования. Спустя 24 ч после i.n. введения 5x105 БОЕ РСВ животные получали препарат XC221GI (20 мг/кг/сут) p.o. с питьевой водой в течение 9 дней. Животные, инфицированные РСВ, которым давали чистую питьевую воду, служили положительным контролем. Животные, получавшие PBS и питьевую воду, служили отрицательным контролем. В легких, извлеченных на 10-й день после инфицирования, оценивали титр вируса и выраженность гистопатологических изменений. Для каждого образца легкого готовили четыре слайда, окрашенных H&E, Duffy, PAS или толуидиновым синим, которые были использованы для детальной оценки патологии (См. раздел «Критерии оценки патологии у хлопковых крыс при РСВ инфекции», приведенный в дополнительных материалах к статье). Дифференцировали также полиморфноядерные лейкоциты и классифицировали их как нейтрофильные и/или эозинофильные с помощью гистохимического окрашивания Duffy (окраска эозинофилов). Для оценки количества, рас-пределения и морфологии тучных клеток использовали препараты, окрашенные толуидиновым синим. Оценку бокаловидных клеток проводили по препаратам, окрашенным PAS. Также оценивали гиперплазию/гипертрофию слизистых клеток и гиперплазию бронхиолярного эпителия. Для получения общего балла гистопатологии оценки складывали. Данные представляли в виде доли животных (%) с суммарной оценкой гистопатологических изменений от 1 до 8 баллов при оценке перибронхиолита и от 1 до 6 баллов при оценке интерстициальной пневмонии и альвеолита.
Титрование РСВ в легких животных на клетках HEp-2
Ткани легких, предназначенные для анализа, взвешивали и гомогенизировали в 3.0 мл HBSS буфера с добавлением 10% буфера SPG (сахароза/фосфат/ глютамат). Гомогенаты легких осветляли центрифугированием и разводили в среде EMEM. Монослой HEp-2 инфицировали 10-кратными разведениями в 24-луночных планшетах. После 1 ч инкубации при 37℃ в инкубаторе с 5% СО2 лунки покрывали средой с 0.75% метилцеллюлозой. Через 4 дня инкубации верхний слой удаляли и клетки фиксировали 0.1% кристаллическим фиолетовым в течение 1 ч, затем промывали и сушили на воздухе. Подсчитывали число бляшек и выражали титр вируса в БОЕ на грамм ткани легкого.
Эффект XC221GI на привлечение нейтрофилов и продукцию хемокинов CXCL9, CXCL10, CXCL11 в легких мышей
Животные
Эксперименты выполнены на 10-недельных самцах мышей линии C57BL6 массой 26.9±1.7 г, приобретенных в питомнике филиала «Андреевка» ФГБУН «Научный центр биомедицинских технологий» ФМБА России (г. Андреевка Московской области). Животных содержали в клетках с контролируемой средой обитания со стандартным гранулированным кормом и водой. Все эксперименты на животных были одобрены Комитетом по этике животных ООО «Фарминтерпрайсез» (Ветеринарные свидетельства № 12896925029 от 11.01.2022, № 12896967735 от 11.01.2022; Протокол БЭК № 14/2021 от 28.12.2021). Экспериментальные процедуры с животными проводили в соответствии с Руководством по уходу и использованию лабораторных животных [36]. Все процедуры с животными проводили с использованием наркоза.
Введение IFNγ мышам и определение количества нейтрофилов и хемокинов CXCL10, CXCL9 и CXCL11
Животные были разделены на группы, и после анестезии им вводили (i.n.) в объеме 30 мкл (100 нг/мкл, в правую ноздрю) рекомбинантный IFNγ (R&D systems, США) и сразу вводили ХС221GI в дозах 0.3, 3 или 15 мг/кг, однократно, внутрижелудочно, или препарат сравнения –дексаметазон (ПАО «Брынцалов-А», Россия) в дозе 1 мг/кг. Группа контрольных животных получала стерильный физиологический раствор. Животные интактной группы получали только физиологический раствор без препарата и без IFNγ. Далее у животных под терминальной анестезией через 8–12 ч собирали образцы бронхоальвеолярного лаважа (БАЛ). Для этого трахею иссекали и вставляли пластиковую канюлю, воздушное пространство промывали 1 мл PBS, предварительно нагретого до 37℃. C помощью камеры Горяева определяли абсолютное количество клеток в БАЛ. БАЛ центрифугировали при 200 g в течение 10 минут и из клеточного осадка готовили мазки, которые фиксировали в метаноле, окрашивали по Романовскому-Гимзе и считали количество нейтрофилов. В БАЛ также определяли уровень хемокинов CXCL10, СXCL9 и CXCL11 с использованием тест-систем IP-10 (CXCL10) Mouse ELISA Kit (Thermo Fisher Scientific, США), MIG/CXCL9 Mouse ELISA Kit (R&D Systems, США) и CXCL11/I-TAC DuoSet (R&D Systems, США).
Статистический анализ
Статистический анализ данных проводили с использованием программного обеспечения GraphPad Prism 8 (США). Данные представляли как среднее арифметическое (M) ± стандартное отклонение (standard deviation, SD) или стандартная ошибка среднего (standard error of the mean, SEM). Оценку статистической достоверности различий между группами проводили с помощью однофакторного дисперсионного анализа One-way ANOVA с последующим тестом Tukey при уровне значимости межгрупповых различий p<0.05.
РЕЗУЛЬТАТЫ
Оценка влияния ХС221GI на экспрессию IL6 и IL8 при РСВ инфекции in vitro
Концентрация ранних цитокинов и хемокинов IL6, IL8 и TNFα при вирусной инфекции в крови может служить маркером тяжести заболевания [37]. При гипервоспалении их концентрации существенно возрастают. При тяжелой инфекции SARS-CoV-2 IL6 играет центральную роль [25, 38]. У людей, инфици-рованных РСВ, более тяжелое течение заболевания коррелировало с повышенными концентрациями IL1β, IL1RA, IL6, IL7, IL8, G-CSF, CXCL9 [39-41].
На первом этапе исследования мы изучили влияние XC221GI на индукцию IL6 и IL8 при РСВ инфекции in vitro. Мы показали, что в культуре клеток A549, инфицированных РСВ, присутствие XC221GI в течение 48 ч приводило к подавлению синтеза IL6 (на 55–85%) и IL8 (на 40%), которое носило концентрационнозависимый характер (Рис. 1 А, Б). Ингибирование 50% IL6 достигалось при 27.6 нмоль/л (6.1 нг/мл) XC221GI. В неинфицированных клетках А549 препарат XC221GI не оказывал влияния на уровень IL8. Уровень IL6 в неинфицированных клетках был ниже предела определения и не изменялся в присутствии XC221GI.

В диапазоне концентраций до 500 мкг/мл не наблюдали цитотоксический эффект XC221GI в отношении клеток А549 в MTT тесте (данные не представлены).
Влияние XC221GI на патологические изменения в легких хлопковых крыс при РСВ инфекции
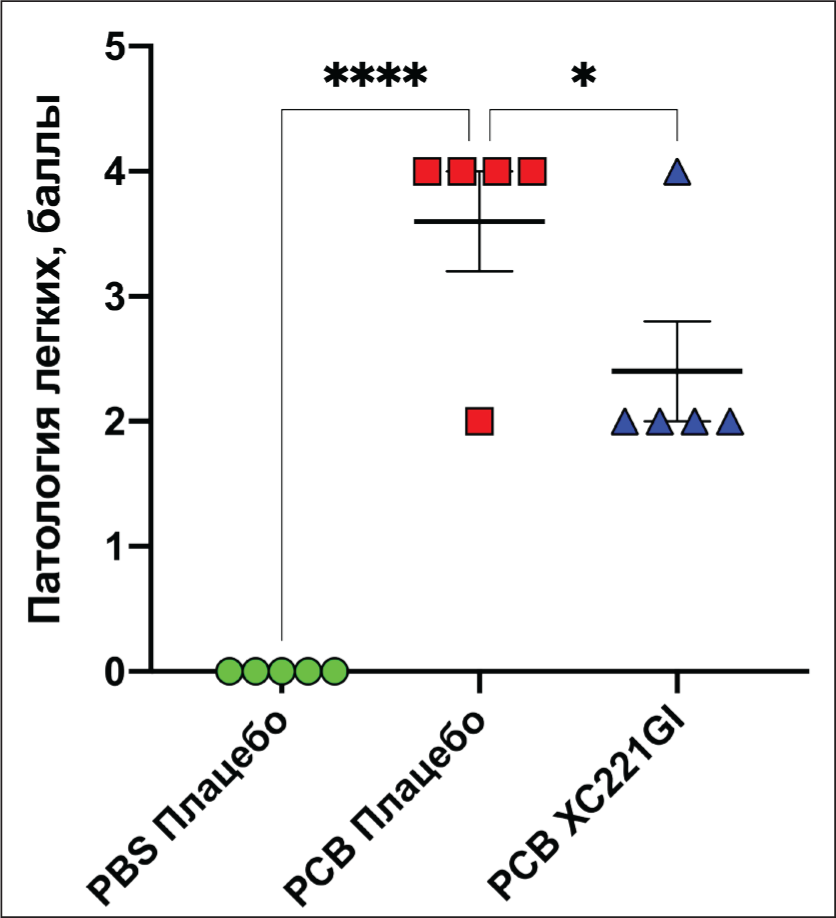
Противовоспалительная активность ХС221GI при вирусном поражении легких, вызванном РСВ, была изучена в серии экспериментов in vivо на хлопковых крысах. У хлопковых крыс, инфицированных РСВ, оценивали эффект ХС221GI (20 мг/кг/сут) на патологию легких при ежедневном введении (p.o.) с питьевой водой в течение 5 суток, начиная через 24 ч после инфицирования.
Оценку проводили на 6-е сутки, когда патология была наиболее выражена. Введение животным ХС221GI приводило к достоверному снижению в легких выраженности альвеолита и интерстициальной пневмонии по сравнению с животными контрольной группы, инфицированными РСВ и получавшими воду без исследуемого соединения (РСВ Плацебо) (Рис. 2).
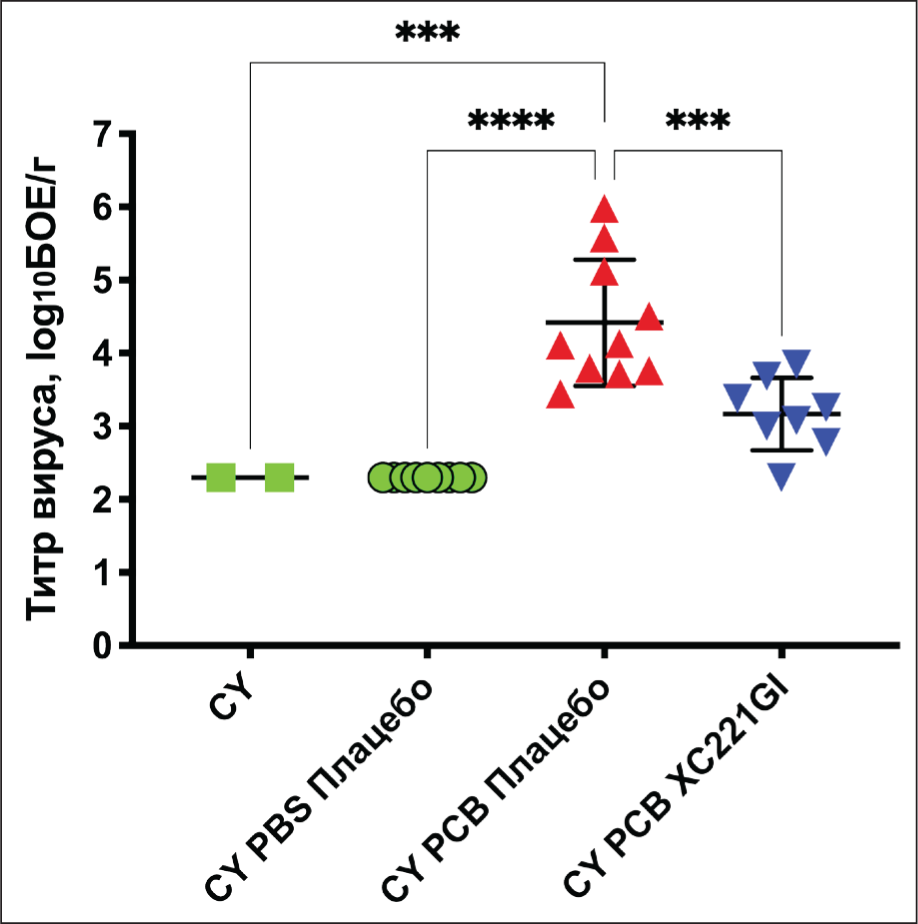
Эффект XC221GI (20 мг/кг/сут) на вирусную нагрузку и на патологию в легких хлопковых крыс, вызванную РСВ инфекцией, был изучен также на модели животных c иммуносупрессией. Максимальная патология у животных с иммуносупрессией отмечалась на 10-е сутки после инфицирования и на этот же срок наблюдали достоверное снижение титра РСВ в легких животных, леченных XC221GI, по сравнению с животными контрольной группы (Рис. 3).
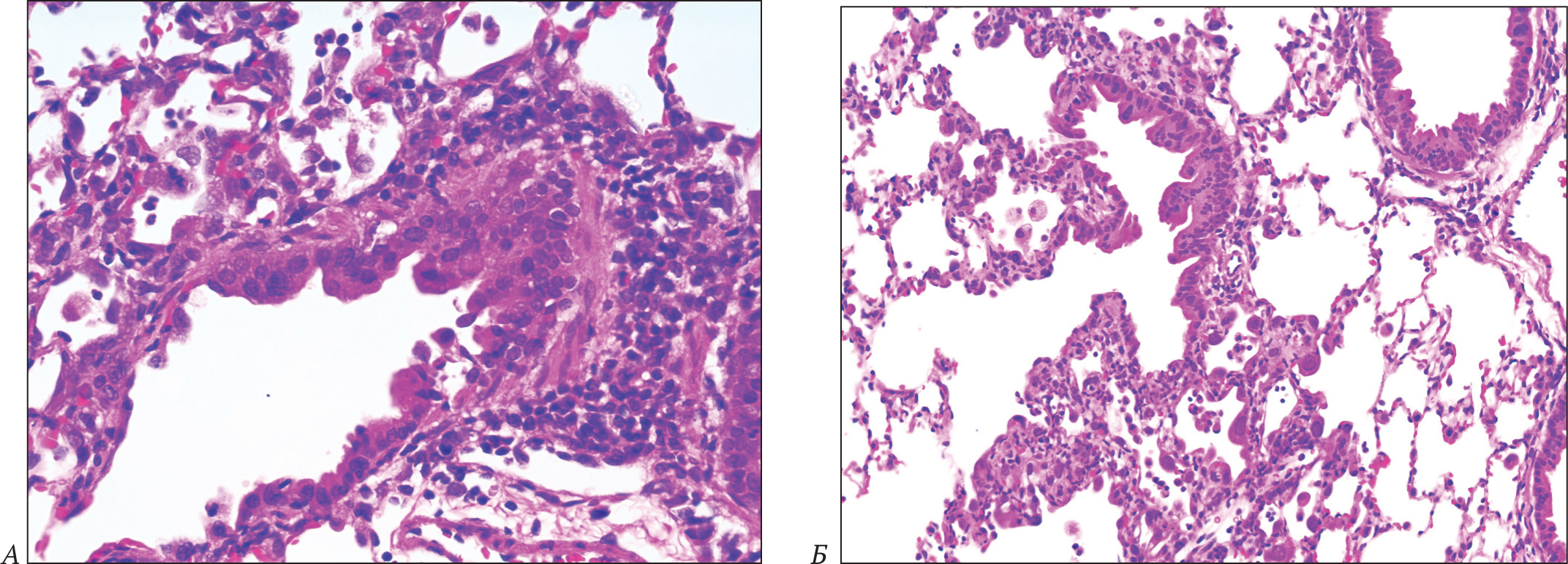
Детальное изучение патологии в легких хлопковых крыс включало анализ срезов, окрашенных H&E, Duffy, PAS и толуидиновым синим на предмет наличия: воспалительных клеточных инфильтратов в перибронхиолярной соединительной ткани и, в меньшей степени, в бронхиолярном эпителии (перибронхиолит); воспаления в альвеолярном септальном интерстициуме вблизи и внутри терминальных бронхоальвеолярных каналов (интерстициальная пневмония); а также экссудатов воспалительных клеток в альвеолярном воздушном пространстве (альвеолит). Патологию оценивали в баллах, которые суммировали для каждого показателя. Критерии оценки приведены в разделе «Критерии оценки патологии у хлопковых крыс при РСВ инфекции», представленном в дополнительной информации к статье.
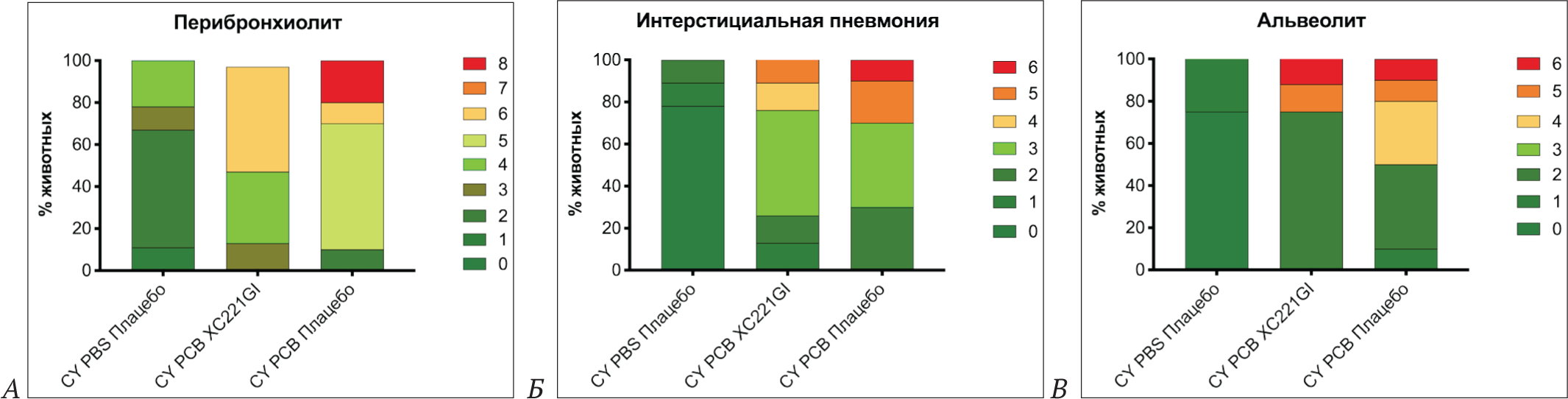
РСВ инфекция вызывала перибронхиолит, харак-теризующийся наличием подслизистых периброн-хиолярных интерстициальных инфильтратов пре-имущественно мононуклеарных воспалительных клеток с примесью эозинофилов и нейтрофилов. Окрашивание срезов легких H&E выявило перибронхиолит во всех группах инфицированных РСВ животных. Патология была наиболее выражена у животных контрольной группы, получавших плацебо. В более пораженных образцах перибронхиолит распространялся глубоко, с вовлечением терминальных бронхиол. Эозинофилы были незначительным компонентом воспалительного процесса. В группе хлопковых крыс, леченных ХС221GI, не выявили животных с патологией тяжелой степени тяжести (Рис. 4, 5 А). Оценка степени тяжести интерстициальных воспалительных клеточных инфильтратов также показала снижение выраженности интерстициальной пневмонии у хлопковых крыс, которым вводили XC221GI, по сравнению с животными группы плацебо (Рис. 5 Б).
Влияние XC221GI на привлечение нейтрофилов и продукцию хемокинов CXCL10, CXCL9, CXCL11 в легких мышей
При инфицировании людей вирусами SARS-CoV-1 и SARS-CoV-2 частым осложнением является усиление воспаления с последующим развитием MIS [42, 43]. Критическим фактором развития легочной патологии при COVID-19 служит передача сигналов хемокинов оси CXCL10-CXCR3 [44]. Повышенная экспрессия CXCL10 и родственных лигандов CXCL9 и CXCL11 рецептора CXCR3 выявлена в БАЛ и мононуклеарных клетках периферической крови (peripheral blood mononuclear cells, PBMC) пациентов с тяжелой формой COVID-19. При воспалительном процессе в легких выявлена популяция нейтрофилов, экспрессирующих рецептор CXCR3 [45]. Поскольку IFNγ может напрямую передавать сигналы эпителиальным клеткам, индуцируя хемокины, мы разработали модель притока нейтрофилов и индукции хемокинов CXCL10, CXCL9 и CXCL11 в легких мышей после i.n. введения мышам IFNγ. Мы показали, что после однократного введения IFNγ достоверное повышение уровня нейтрофилов в бронхоальвеолярном лаваже по сравнению с интактными животными обнаруживается уже через 4 ч и продолжает нарастать до 12 ч (Рис. 6 А). Кроме того, введение IFNγ через 2 ч приводило к статистически достоверному повышению уровня CXCL10 в БАЛ, и его высокий уровень сохранялся на протяжении 12 ч (Рис. 6 Б).
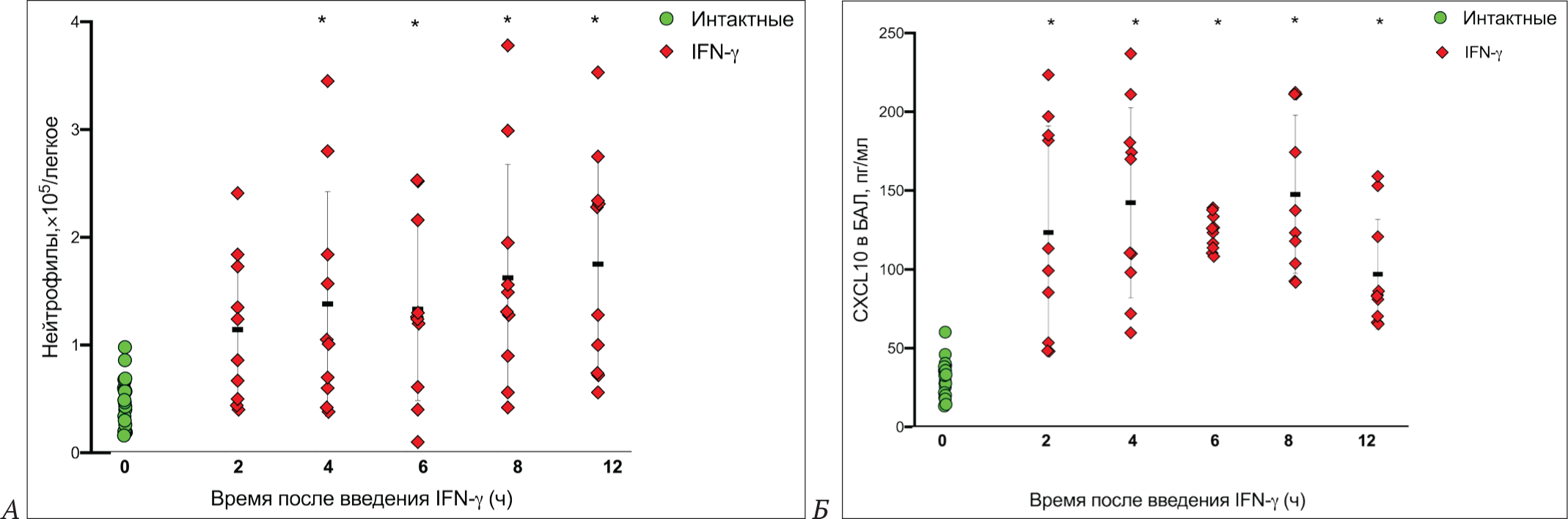
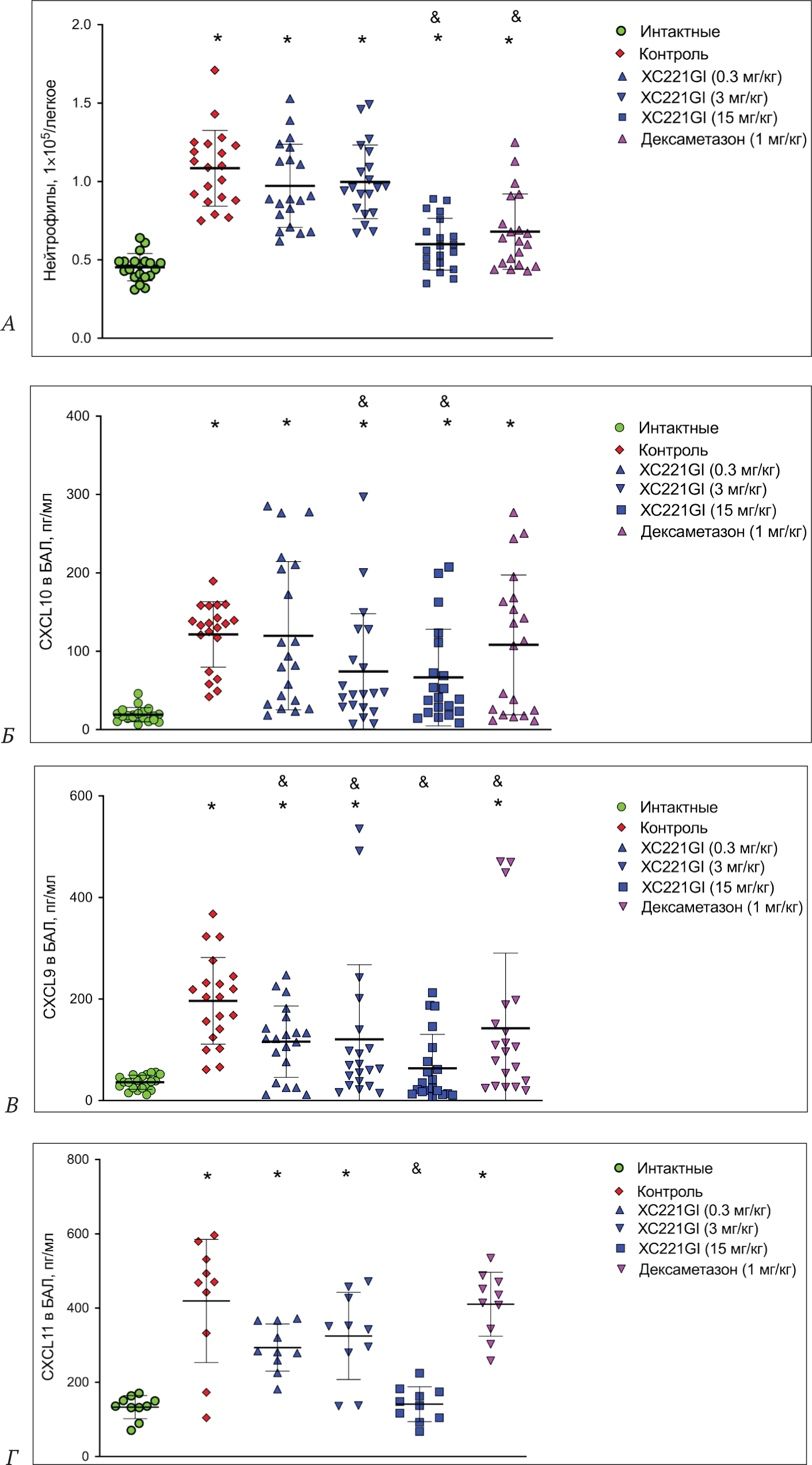
Далее мы изучили, как влияет введение XC221GI мышам на уровень нейтрофилов и хемокинов CXCL10, CXCL9 и СXCL11 в легких после однократного введения IFNγ. При введении животным IFNγ и ХС221GI в дозе 15 мг/кг через 8–12 ч в БАЛ отмечали статистически достоверное снижение числа нейтрофилов по сравнению с группой контрольных животных, которым вводили плацебо (Рис. 7 А). Эффект снижения нейтрофилов под действием XC221GI был сопоставим с действием дексаметазона (1 мг/кг). Изучение влияния XC221GI на хемокины – лиганды CXCR3 рецептора – показало, что однократное введение препарата XC221GI (в дозах 3 и 15 мг/кг) дос-товерно снижало CXCL10 и CXCL9 через 8–12 ч после введения IFNγ (Рис. 7 Б, В). Дексаметазон приводил к достоверному снижению CXCL9. Препарат XC221GI (в дозе 15 мг/кг), но не дексаметазон, приводил к до-стоверному снижению СXCL11 в бронхоальвеолярном лаваже через 8 ч после введения IFNγ (Рис. 7 Г).
ОБСУЖДЕНИЕ
Один из основных провоспалительных цитокинов при инфекционном процессе, вызванном респираторными вирусами, − IL6 [46, 47]. Блокирование IL6-R рецептора с помощью моноклонального антитела тоцилизумаб приводит к быстрому улучшению состояния пациентов с тяжелым течением COVID-19 [48]. Таким образом, IL6 может являться релевантной терапевтической мишенью при лечении вирус-ин-дуцированного воспаления. Также терапевтической мишенью может служить IL8, повышенный уровень которого наблюдается в плазме крови пациентов, инфицированных SARS-CoV-2, с тяжелым течением заболевания COVID-19 [49]. IL8 вызывает массивный приток нейтрофилов в интерстиций, периваскулярное и перибронхиальное пространство легких, приводя к их повреждению [50, 51]. Кроме того, IL8 играет ключевую роль в развитии фенотипа протромботических нейтрофилов у больных. Блокирование передачи сигналов IL8 с помощью анти-IL8 моноклонального антитела или блокатора рецепторов CXCR1/2 (репариксин) [52] снижало активацию нейтрофилов в эксперименте in vitro, а также приводило к снижению тяжести острого респираторного дистресс-синдрома (ОРДС), вызванного SARS-CoV-2, у мышей [49].
Мы изучили влияние XC221GI на вирусное вос-паление в экспериментах in vitro и in vivo при РСВ инфекции и показали, что препарат XC221GI эффективно подавлял РСВ-индуцированную продукцию IL6 (45–85%) и IL8 (40%) в эпителиальных клетках карциномы человека. Важно отметить, что XC221GI не влиял на спонтанную продукцию цитокинов IL-6 и IL-8 в отсутствие РСВ вируса.
Респираторные вирусы, попадая в эпителиальные клетки верхних дыхательных путей через брон-хиолярный эпителий, проникают в нижние отделы респираторного тракта, вызывая бронхиолит. РСВ ответственен за 70% всех бронхиолитов у детей и яв-ляется основной причиной гибели детей первых двух лет жизни [53]. Второе место по частоте бронхиолитов у детей занимают риновирусы. Сезонные коронавирусы не являются частой причиной бронхиолитов, однако ситуация изменилась с появлением SASR-CoV-2 варианта В.1.1.529 (Омикрон). Штамм Омикрон хуже размножается в легких животных по сравнению с предыдущими вариантами [54], реже приводит к пневмониям, но вызывает резкий подъем заболеваемости среди детей с большой частотой по-явления тяжелых заболеваний, включая круп, брон-хиолит и бронхообструкцию [55].
Бронхиолит, вызванный РСВ, характеризуется нейтрофилией, выбросом воспалительных цитокинов, гиперсекрецией слизи, которая может закупоривать просвет бронхиол, способствуя бронхиолярной обструкции [56]. Рекомендуемой моделью для изучения РСВ инфекции служат хлопковые крысы, у которых к 5-6-му дню после инфицирования развивается интерстициальная пневмония, альвеолит и пролифе-ративный бронхиолит [57]. На модели РСВ инфекции у хлопковых крыс мы изучили влияние XC221GI на вирус-индуцированную патологию в легких животных. Мы показали, что введение XC221GI в течение 5 дней приводило к достоверному снижению выраженности интерстициальной пневмонии и альвеолита у леченых животных.
Инфицирование РСВ хлопковых крыс с иммуносу-прессией вызывало типичную бронхиолярную и ин-терстициальную воспалительную реакцию в легких с присутствием перибронхиолярных и альвеолярных инфильтратов мононуклеарных воспалительных клеток, нейтрофилов и эозинофилов. Лечение животных XC221GI в течение 9 дней приводило к достоверному снижению вирусной нагрузки в легких и снижению патологии при анализе перибронхиолярных, интерстициальных и альвеолярных изменений. У леченых животных не были выявлены случаи пери-бронхиолита и интерстициальной пневмонии с тяжелой степенью поражения легочной ткани в отличие от животных контрольной группы.
При тяжелом вирус-индуцированном воспалении респираторного тракта у людей наблюдаются также повышенные уровни хемокинов CXCL10, CXCL9, CXCL11 – лигандов рецептора CXCR3. CXCR3 считается воспалительным хемокиновым рецептором, так как экспрессируется лейкоцитами, которые мигрируют к местам воспаления. Повышенные уровни CXCL10 в легких вызывают инфильтрацию нейтрофилами, экспрессирующими рецептор CXCR3. Такие нейтрофилы обнаруживаются у пациентов с хроническим заболеванием легких, но не у здоровых людей [58]. CXCL10-CXCR3 сигналинг является критическим фактором усиления патологии в легких при мульти-системном воспалении за счет действия на хемотаксис нейтрофилов [44], а также связан с патофизиологией заболеваний Th1 типа, включая аутоиммунные, сердечно-сосудистые и инфекционные [59, 60].
IFNγ, являясь регулятором иммунного ответа на инфекцию, индуцирует все три лиганда CXCR3 − CXCL10, CXCL9 и CXCL11, – активируя JAK/STAT/Akt сигналинг [61-63]. Хемокины CXCL10, CXCL9 и CXCL11 обладают сходным составом белковой последователь-ности с идентичностью до 40% [64]. Хемокины CXCL9 и CXCL10 вызывают поляризацию эффекторных клеток Th1/Th17 и поддерживают воспалительную реакцию [65]. CXCL10 вовлечен в хемотаксис, апоптоз, ангиостаз и служит основным маркером ОРДС [26, 66]. При тяжелой форме COVID-19 хемокины CXCL10, CXCL9 и CXCL11 обильно индуцируются в эпителиальных клетках легких человека. В сыворотке пациентов с генерализованным воспалением, вызванным SARS-CoV-2, отмечали значительное повышение уровня CXCL9 [31], который включен в перечень 10 хемокинов, связанных с повышенным риском смертности [6]. Измерение профиля хемокинов CXCL9, CXCL10 и CXCL11 позволяет выявить COVID-19 пациентов с повышенным риском развития осложнений. Таким образом, контролируя уровень хемокинов, возможно обеспечить контроль вирусной инфекции.
Ось CXCL10-CXCR3 является важной терапевтиче-ской мишенью при лечении острой фазы легочного воспаления. Мы изучили эффект XC221GI на приток нейтрофилов в бронхоальвеолярное пространство легких мышей и индукцию хемокинов CXCL10, CXCL9 и CXCL11 после i.n. введения животным IFNγ. В разработанной нами модели мы показали, что однократное введение XC221GI приводило к достоверному снижению притока в легкие нейтрофилов и снижению продукции всех трех лигандов − CXCL9, CXCL10 и CXCL11 – уже через 8–12 ч после введения IFNγ. Эффект XC221GI на приток в легкие нейтрофилов и CXCL9 был сопоставим с действием дексаметазона. Статистически значимого эффекта дексаметазона на CXCL10 и CXCL11 в этой модели не отмечали.
Полученные результаты доклинического изучения фармакодинамической активности соединения XC221GI характеризуют уникальный противовоспалительный профиль действия его молекулы, выражающийся в возможности управления уровнем продукции ключевых маркеров воспаления и гипервоспаления при РСВ. Доказанный контроль продукции IL6 и IL8, а также CXCL10, CXCL9 и CXCL11 с помощью XC221GI является ключевым свойством молекулы для обоснования ее применения при РСВ инфекции и, возможно, при SARS-CoV-2.
Данные результаты позволяют предположить, что XC221GI может быть применен в качестве средства упреждающей противовоспалительной терапии как при РСВ с целью снижения вирусного поражения лёгочной ткани, так и при COVID-19 на всех этапах воспалительного процесса для предотвращения развития гиперцитокинемии и ее последствий, включая тромбоэмболические нарушения и дисфункцию ключевых органов жизнеобеспечения.

