ВВЕДЕНИЕ
Онкологические заболевания – вторая по значимости причина смерти во всем мире. По данным Всемирной организации здравоохранения (ВОЗ), в 2020 году в мире было зарегистрировано 9.9 миллиона смертных случаев от рака [1]. В России, согласно данным Государственного ракового регистра, в том же году выявлено 556036 случаев онкологических заболеваний. Ведущими локализациями в общей структуре онкологической заболеваемости в России являются молочная железа (11.8%), кожа (10.9%), трахея, бронхи, легкое (9.8%), ободочная кишка (7.2%), предстательная железа (7.9%), желудок (5.8%), прямая кишка, ректосигмоидное соединение (5.1%), лимфатическая и кроветворная система (5%), тело матки (4.3%), почка (3.8%), поджелудочная железа (3.4%), шейка матки (2.8%), мочевой пузырь (2.8%), яичник (2.4%) [2].
До последнего времени основными методами лечения рака являются химиотерапия и лучевая терапия, имеющие серьезные побочные явления. Лекарственная терапия рака менее болезненна и во многих случаях может быть более предпочтительным эффективным лечением. Однако многие опухоли устойчивы к стандартным методам лечения, и со временем возникает рецидив заболевания. Одним из новых подходов в лечении рака служит онколитическая ви-ротерапия, которая активно развивается в последнее десятилетие. Наиболее сложной проблемой в онколитической виротерапии является выбор вируса, который сможет заразить опухоль, разрушить ее и вызвать иммунный ответ к опухолевым клеткам. Противоопухолевая эффективность в эксперименте на животных была показана для вирусов многих семейств, что позволило инициировать клинические испытания для лечения разных форм рака.
Онколитическая виротерапия имеет давнюю историю. Еще в 1904 г. George Dock описал клинический случай с резким снижением числа лейкоцитов у больного лейкозом после перенесенного гриппа [3]. В том же году итальянский врач Nicola De Pace описал случай исчезновения раковой опухоли шейки матки у пациентки после введения живой вакцины против бешенства в связи с укусом собаки. Аналогично, после введения вакцины против бешенства, содержащей ослабленный вирус, у нескольких пациенток с таким же диагнозом опухоли уменьшились в размерах, од-нако позже у всех болезнь рецидивировала и привела к летальному исходу [4]. В 1940 г. Pack провел первые клинические испытания, применив вакцину против бешенства для лечения меланомы, что вызвало частичную ремиссию заболевания [5]. В 60-х годах исследование Lindenmann и Klein показало, что иммунизация мышей гомогенатом опухолевых клеток, инфицированных вирусом гриппа, приводит к появлению гуморального иммунного ответа против антигенов, ассоциированных с опухолевыми клетками [6, 7].
Онколитическими вирусами могут быть непатогенные или слабопатогенные для человека вирусные штаммы дикого типа и естественно ослабленные штаммы, используемые без генетических модификаций (например, реовирус) [8]. Кроме того, создаются генетически модифицированные вирусы с изменениями в геноме, приводящими к снижению вирусной патогенности и повышению терапевтического эффекта [9, 10]. Развитие рекомбинантных ДНК-технологий открыло новые возможности и позволило получить большой спектр химерных (рекомбинантных) вирусов с модификациями, направленными на уничтожение раковых клеток. Первое исследование с применением генетически модифицированного вируса простого герпеса 1-го типа (herpes simplex virus 1, HSV1, dlsptk) со сниженной нейровирулентностью за счет удаления гена γ34.5, кодирующего тимидинкиназу (thymidine kinase, HSV-TK), было опубликовано в 1991 г [11]. Такая модификация вирусного генома приводила к сниженной репродукции вируса в нормальных клетках при полноценной репродукции в опухолевых клетках, содержащих повышенную концентрацию TK [12]. Зависимость дефектного по ТК вируса от уровня содержания этого фермента в клетке давала возможность использовать модифицированный вирус для лечения глиомы у мышей, которое приводило к регрессу опухоли.
На сегодняшний день описано 9 семейств вирусов, обладающих онколитическим потенциалом, а именно: Rhabdoviridae, Poxviridae, Herpesviridae, Reoviridae, Adenoviridae, Paramyxoviridae, Picornaviridae, Togaviridae, Parvoviridae. Представители этих семейств показали положительный терапевтический эффект в отношении многих злокачественных новообразований разного генеза и различной локализации в макроорганизме (данные суммированы в Таблице 1). Кроме того, появилось несколько зарегистрированных препаратов, например, адаптированный к меланоме генетически модифицированный энтеровирус ECHO-7 (Латвия) с онколитическими и иммуномодулирующими свойствами, названный «Ригвир» (RIGVIR) [13]. В 2003 году Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов Китая (China Food and Drug Administration, CFDA) был одобрен препарат Gendicine на основе аденовирусного вектора с делецией E1 для лечения злокачественных опухолей головы и шеи. Однако дефектный по репликации онколитический препарат обладал низкой трансфицирующей активностью для раковых клеток. Тем не менее, Gendicine – коммерчески доступное виротерапевтическое лекарственное средство, которое находит клиническое применение. Препарат продолжают исследовать для лечения рака легких, печени, гинекологических злокачественных новообразований и сарком мягких тканей [14]. В 2005 году в Китае зарегистрирован препарат на основе генетически модифицированного аденовируса Н101, получивший название Онкорин (Oncorine), для лечения злокачественных опухолей головы и шеи, происходящих из клеток плоского эпителия [15]. Управление по контролю качества пищевых продуктов и лекарственных препаратов США (Food and Drug Administration, FDA) и Европейское агентство лекарственных средств (European Medical Agency, ЕМА) одобрили противоопухолевый препарат Talimogene laherparepvec (T-VEC) на основе HSV1 для лечения неоперабельных кожных, подкожных и узловых поражений у пациентов с рецидивом меланомы после хирургического удаления первичной опухоли [16, 17]. Данный вирус модифицирован для селективного роста в опухолевых клетках и экспрессии гранулоцитарно-макрофагального колониестимулирующего фактора (granulocyte-macrophage colony-stimulating factor, GM-CSF), обладающего иммуностимулирующей активностью.
| Семейство | Вирусный онколитик | Опухолевая специфичность | Ссылки | |
|---|---|---|---|---|
| Штамм | Дизайн | |||
| Adenoviridae | ONYX-015 | Тип 2/5, делеция 827 пар нуклеотидов в гене Е1В, нарушающая экспрессию белка Е1В 55К | Рецидивирующая плоскоклеточная карцинома головы и шеи (Ф2)1
Аденокарцинома поджелудочной железы (Ф1) Метастатические солидные опухоли (Ф1) Рак молочной железы Колоректальная аденокарцинома Гепатоцеллюлярная карцинома Меланома Рак предстательной железы (Ф2) | [98] [99] [100] [101] [102] [103] [104] [58] |
| Oncorine (H101) | E1B делеция, Е3 частичная делеция | Плоскоклеточная карцинома головы и шеи (Ф3) | [105] | |
| DNX-2401 | Делеция 24 пар нуклеотидов в E1A, вставка RGD-4C | Глиома (Ф1) Глиобластома (Ф1) | [106] | |
| VCN-01 | Вставка RGDK, гиалуронидазы PH 20 | Поджелудочная внутрипротоковая аденокарцинома Меланома | [107] | |
| ONCOS-102 | Делеция 24 пар нуклеотидов в E1A, вставка RGD, GM-CSF, замена домена Ad5 на Ad3 | Солидные опухоли (Ф1) Мезотелиома Рак яичников | [108] [109] [110] | |
| ICOVIR-7, ICOVIR-5 | Делеция 24 пар нуклеотидов в E1A, Вставка RGD-4C, модификация E2F промотора Делеция 24 пар нуклеотидов в E1A, Вставка RGD, модификация E2F промотора | Солидные опухоли Меланома (Ф1) | [111] [112] | |
| CG0070 | Модификация промотора E2F-1; вставка GM-CSF | Рак мочевого пузыря (Ф1, Ф2) | [113] | |
| Herpesviridae | Talimogene laherparepvec (T-VEС) | ICP34.5, ICP47 делеция, GM-CSF вставка | Меланома, в том числе меланома с мутацией в гене BRAF (лицензирован FDA, EMA) Нейроэндокринные опухоли Рак молочной железы (Ф1) Плоскоклеточный рак головы и шеи | [114, 115] [116] [117] [118] |
| HF-10 | Отсутствие экспрессии UL43, UL49.5, UL55, UL56 и LAT, гиперэкспрессия UL53, UL54 | Плоскоклеточный рак головы и шеи (Ф1, Ф2) Рак поджелудочной железы (Ф1) | [119] [120] [183] | |
| G207 | ICP34.5 делеция, замена ICP6 на LacZ | Глиома (Ф1) | [121] | |
| SEPREHVIR (HSV1716) | ICP34.5 делеция | Солидные опухоли (Ф1) Нейробластома | [122] [123] | |
| М032 | Экспрессия IL12 | Глиома (Ф1) | [156] | |
| G47∆ | ICP34.5, ICP47делеция, замена ICP6 на LacZ | Рак простаты | [124] | |
| Paramyxoviridae | MV-CEA | CEA вставка | Рак яичников (Ф1) Рак молочной железы Колоректальный рак Рак простаты Гепатоцеллюлярная карцинома Мезотелиома Миелома Глиома | [125] [126] [126] [127] [128] [129] [130] [131] |
| MV-NIS | NIS вставка | Глиома | [131] | |
| NDV V4UPM, MTH-68/H | Вакцинный штамм NDV для домашней птицы | Глиома | [132] | |
| Picornaviridae | PVS-RIPO | Вакцинный штамм полиовируса типа 1, вставка HRV2 IRIS | Глиома | [133] |
| SVV-001 | Seneca Valley вирус, изолят 001 | Глиома Нейроэндокринные опухоли (ретинобластома) Мелкоклеточный рак легкого | [134] [135] [135] | |
| Poxviridae | Pexastimogene devacirepvec (Pexa Vec/JX-594) | J2R ген замещен на hGM-CSF и lacZ | Колоректальный рак (Ф1) Гепатоцеллюлярная аденокарцинома (Ф1) Нейробластома (Ф1) Солидные опухоли (Ф1) | [136] [137] [138] [139] |
| GL-ONC1 | Вставка трех кассет (люцифераза Renilla, β-галактозидаза и β-глюкуронидаза). Делеция генов A56R, F14.5L и J2R | Плоскоклеточная карцинома головы и шеи (Ф1) Перитонеальный канцероматоз (Ф1) | [140] [141] | |
| Reoviridae | Pelareorep (Reolysin) | Встречающийся в природе реовирус | Поджелудочная внутрипротоковая аденокарцинома (Ф2) Рак молочной железы (Ф2) Колоректальная аденокарцинома Плоскоклеточный немелкоклеточный рак легкого Меланома (Ф2) | [142] [143] [144] [145] [146] |
| Parvoviridae | H-1 PV | Протопарвовирус H-1 (H-1PV) | Поджелудочная внутрипротоковая аденокарцинома с перитонеальным канцероматозом | [147] |
| Rhabdoviridae | MG1MA3 | MAGE-A3 вставка | Глиобластома (Ф2) | [148] [161] |
| VSV-IFNβ | IFNβ, NIS вставка генов | Миелома Острый миелоидный лейкоз Плоскоклеточный немелкоклеточный рак легкого Рак эндометрия | [148] [148] [149] [150] | |
1Ф – фаза клинических испытаний онколитического вируса.
Таким образом, онколитические вирусы – перспективные противоопухолевые агенты, которые могут применяться как для самостоятельной терапии злокачественных новообразований, так и для комбинированного лечения совместно с хирургическими методами, химио-и лучевой терапией или иммунотерапией.
Основные механизмы действия онколитических вирусов
Согласно современной классификации, выделяют восемь основных признаков, отличающих опухолевые клетки от здоровых, которые включают: поддержание пролиферативной передачи сигналов, уклонение от супрессоров роста, сопротивление клеточной гибели, обеспечение репликативного бессмертия, индукцию ангиогенеза, активацию инвазии и метастазирования, перепрограммирование энергетического метаболизма и уклонение от иммунного разрушения [18, 19]. Многообразие клеточных мишеней, на которые могут быть нацелены вирусы различных семейств, определяет стратегию выбора вируса для лечения рака человека.
Эффективность онколиза зависит в первую очередь от способности вирусов избирательно инфицировать и разрушать раковые клетки. Некоторые вирусы дикого типа, такие как вирус везикулярного стоматита (vesicular stomatitis virus, VSV), HSV, вирус болезни Ньюкасла (Newcastle disease virus, NDV) и реовирус, заражают преимущественно опухолевые клетки, реплицируются, используя репликационный механизм клетки для своего размножения [20-23], и вызывают гибель раковых клеток посредством апоптоза, некроза или аутофагии [24-27]. Другие вирусы, например аденовирус, для ограничения эффективной репликации в нормальных клетках нуждаются в модификации вирусного генома. Этот механизм получил название «нацеливание», или таргетинг (targeting). Так, в большинстве опухолевых клеток белок p53 – фактор транскрипции, который блокирует клеточный цикл и индуцирует апоптоз, – не функционален из-за прямых мутаций в р53 или мутаций в белках, контролирующих его активность или стабильность (белки p14ARF и Mdm2) [28, 29]. Ранний ген E1B аденовируса кодирует белок E1B 55K, который связывается с р53 и защищает инфицированную клетку от преждевременной гибели. Поэтому аденовирус с нефункциональным белком E1B 55K полноценно реплицируется в опухолевых клетках при абортивной репликации в нормальных клетках [30-33]. Другие ДНК-вирусы, например SV40 или вирус папилломы человека 16 (human papilloma virus 16, HPV16), также способны ингибировать p53 [29].
Модифицированный вирус гриппа А, в котором удален ген, кодирующий неструктурный NS1 белок (delNS1), ответственный за противодействие вируса системе интерферона (interferon, IFN), способен убивать раковые клетки с дефектным геном р53 по альтернативному р53-независимому пути [34, 35]. Способность секретировать IFN I типа является одним из основных врожденных механизмов защиты клеток млекопитающих от вирусной инфекции. Опухолевые клетки могут иметь генетические дефекты в генах, которые участвуют в синтезе IFN, что приводит к низкому уровню экспрессии этих генов [36-40]. Отсутствие полноценной системы IFN в раковых клетках делает их более чувствительными к вирусной инфекции и может быть использовано для обеспечения селективного роста цитолитических вирусов [35-38]. Так, вирус гриппа delNS1 характеризуется усиленным цитолитическим потенциалом в раковых клетках [39] и сниженной репродуктивной активностью в здоровых клетках с полноценной системой IFN [40, 41]. Такой вирус гриппа может служить направленным киллером раковых клеток. Сходным образом вирус другого семейства, HSV1, борется с системой IFN хозяина с помощью белка ICP0 (экспрессируемого геном γ34.5). Удаление гена, кодирующего данный белок в геноме HSV1, делает возможной активную репликацию вируса избирательно в раковых, но не в здоровых клетках, имеющих активную систему IFN [42].
Терапевтический эффект вирусов определяется не только лизисом опухолей, но и стимуляцией противоопухолевого иммунитета и устранением иммунной супрессии за счет провоспалительной активации иммунного микроокружения опухоли (tumor immune microenvironment, TIME) [43-49]. Раковые клетки обладают способностью ускользать от иммунной системы за счет мутаций, возникающих в опухолевых антигенах. Онколитические вирусы, заражая опухо-левые клетки, запускают воспалительную реакцию, которая приводит к распознаванию инфицированных вирусом раковых клеток иммунными клетками макроорганизма. В результате происходит индукция цитокинов, активирующих иммунную систему, привлечение и активация дендритных клеток (dendritic cells, DC), стимуляция специфических Т-лимфоцитов и активация эффективного противоопухолевого ответа. В процессе апоптоза и/или некроза происходит высвобождение молекулярных метаболитов, связанных с повреждениями (damage-associated molecular patterns, DAMP) [50], которые распознаются антиген-презентирующими Т-клетками в микроокружении опухоли и приводят к ее гибели.
Для усиления цитолитического иммунного эффекта конструируются вирусы, экспрессирующие дополнительные иммуностимулирующие факторы. Этот феномен получил название «вооружения» (arming) вирусов. В качестве трансгенов используются цитокины, хемокины, костимуляторные белки, биспецифические активаторы Т-клеток (BiTE) или блокаторы иммунных контрольных точек – например, онколитический вирус JX-594 семейства Poxviridae, полученный на основе вируса осповакцины (vaccinia virus, VV) штамма Wyeth, в котором для ослабления вирулентности и ограничения репродукции в нормальных клетках удален ген, кодирующий TK, а для активации антигенпрезентирующих клеток встроен ген, экспрессирующий иммуностимулирующий GM-CSF и репортерный ген lacZ [51-53]. Другой пример − аденовирус (adenovirus, Ad) LOAd703 серотипа 5/35, экспрессирующий лиганды CD40L (TMZ-CD40L) и 41BB (4-1BBL) человека, активирующие CD40 и 4-1BB пути, который является онколитическим вирусом для лечения пациентов с раком поджелудочной железы [54]. Такая генетическая комбинация усиливает иммунитет типа Th1 за счет повышения выработки цитокинов и костимулирующих молекул. Aденовирусы в процессе репликации могут генерировать белки, которые обладают цитотоксичностью. Примером может служить «белок смерти» аденовируса (adenovirus death protein, ADP). ADP синтезируется на поздней стадии инфекции, вызывая лизис клеток. При лизисе высвобождаются новые вирионы, которые инфицируют новые опухолевые клетки [55, 56]. Модифицированный аденовирус С серотипа 5 (Ad5), содержащий ADP в комбинации с химерным суицидальным геном или репортерным геном NIS человека (sodium-iodide symporter, NIS), избирательно подавлял рост клеток опухоли предстательной железы [57-59]. Аденовирусы Ad5 широко используются для конструирования онколитических вирусов. Однако недостатком Ad5 является их широкое распространение в популяции людей и, как следствие, формирование у людей иммунной популяционной резистентности, поскольку до 90% популяции людей имеют антитела к Ad5 [60, 61]. Наличие предсуществующего иммунитета к аденовирусу может ограничивать инфицирование раковых клеток онколитическим вирусом, а также усиливать вирусную токсичность для клеток печени и системы свертываемости крови [62, 63, 64]. Для преодоления популяционной иммунной резистентности при онколитической виротерапии необходимо повышение специфичности вирусного онколитика для раковых клеток посредством включения в вирусный геном элементов, регулирующих специфическую репликацию вируса в раковой клетке, что снижает его общую токсичность для организма и способствует более сильной иммунной реакции организма на опухоль [62, 64, 65]. Другой подход для преодоления иммунного популяционного барьера заключается в использовании для создания онколитиков других сероподтипов, менее распространенных среди людей, например Ad26 и Ad24 [61, 63]. Также изучается возможность использования аденовирусов типа В (серотип Ad11р), к которому у большинства людей нет иммунитета [66].
Для преодоления иммунного барьера целесообразно также использовать последовательное применение серии вирусов-онколитиков разных типов, которые не имеют иммунных перекрестов, – так называемый принцип «кассетной виротерапии». Принцип кассетной виротерапии, помимо преодоления иммунологического барьера, имеет преимущество, обусловленное способностью цитолитических вирусов различных семейств запускать разные механиз-мы программированной гибели (апоптоз, пироптоз, смерть через аутофагию, некроптоз и др.) и воспаления раковых клеток [27]. Данный подход позволяет создать платформу поливалентного действия на опухоль с целью более глубокого повреждения и искоренения опухоли и ее метастазов, включая воздействие на устойчивые к химиотерапии «стволовые» раковые клетки. Принцип кассетной виротерапии онколитическими вирусами различных семейств схематически представлен на Рис. 1.
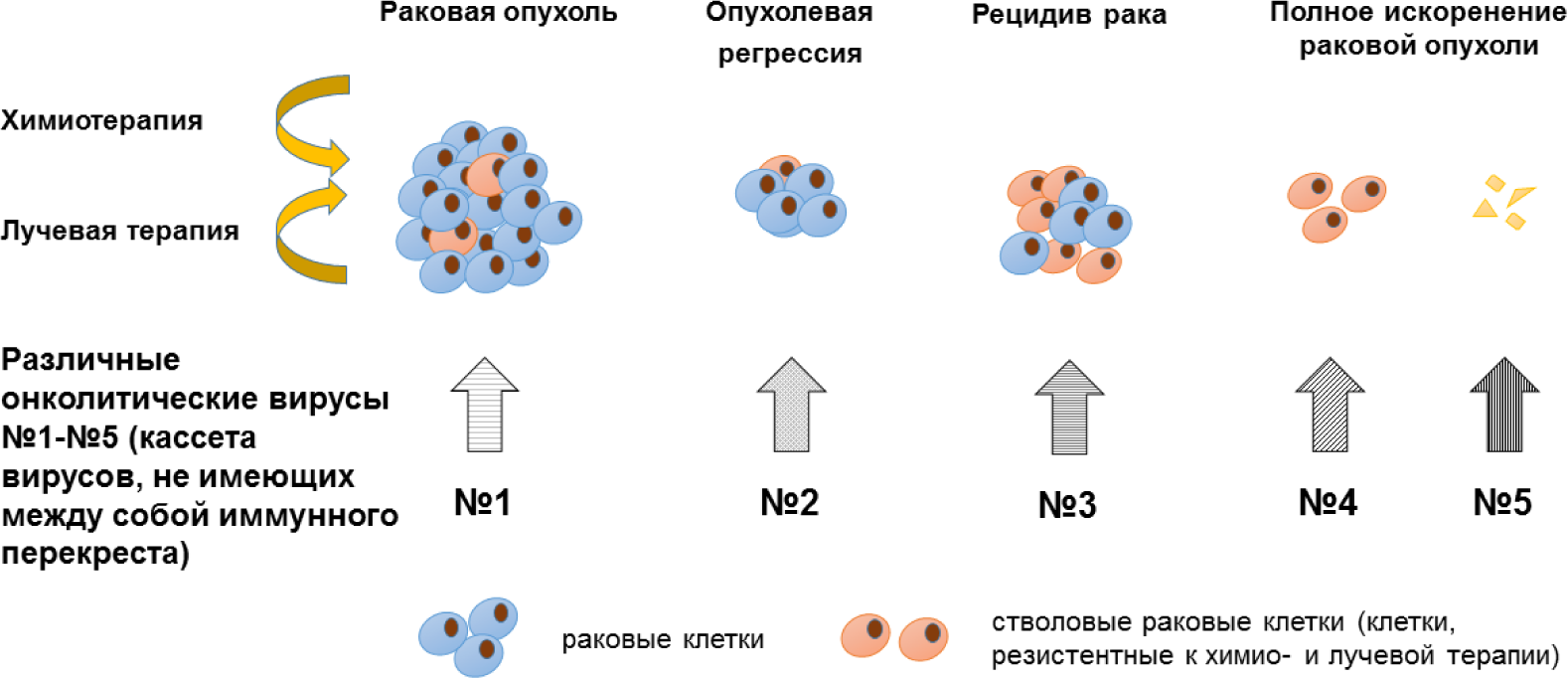
Кассетное применение вирусов позволяет: (1) избежать иммунной реакции макроорганизма, направленной на нейтрализацию онколитического вируса; (2) менять вирус и при этом изменять направленность лечебного вируса по ходу терапевтического курса в зависимости от типа и локализации опухоли (или метастазов); (3) в зависимости от свойств онколитического вируса избирательно вызывать гибель раковых клеток по апоптотическому и/или некротическому пути и тем самым влиять на уровень воспалительной реакции в опухоли; (4) в перспективе разработать специфические оптимизированные кассеты для курса лечения опухолей различного генеза и их полного поэтапного искоренения. В результате возможно полное искоренение как первичной опухоли, так и ее стволовых клонов.
Помимо «нацеливания» и «вооружения» используется еще одна модификация, получившая название «экранирование» (shielding), применяемая для повышения распространения вирусов. Например, в случае наличия у пациента иммунитета к онколитическому вирусу (как в случае Ad5) при терапии рака с использованием системной доставки существует вероятность инактивации онколитического вируса нейтрализующими антителами. Для предотвращения нейтрализации в настоящее время изучаются возможности использования биоразлагаемых синтети-ческих полимеров, например катионного полимера, связанного с полиэтиленгликолем (PEG), поли-(N-(2-гидроксипропил)метакриламидом) (pHPMA) [67, 68] и ДНК-аптамером [69].
Онколитические вирусы могут быть использованы для повреждения кровеносной системы опухоли, которая в значительной мере обеспечивает рост и метастазирование раковых клеток. Образование новых кровеносных сосудов (ангиогенез) контролируется химическими сигналами, одним из которых является фактор роста эндотелия сосудов (vascular endothelial growth factor, VEGF), который связывается с рецепторами на поверхности нормальных эндотелиальных клеток. При этом в эндотелиальных клетках инициируются сигналы, которые способствуют образованию и росту новых кровеносных сосудов. Ингибиторы ангиогенеза действуют на VEGF, препятствуя его ак-тивации и формированию кровеносных сосудов. Вирус-индуцированное подавление ангиогенеза в злокачественной опухоли показано при использовании аденовируса [70, 71], герпесвируса [72], VV [73], вируса везикулярного стоматита (vesicular stomatitis virus, VSV) [74, 75] и вируса кори [76, 77]. Для повышения эффективности проникновения вирусов в сосудистую сеть опухоли применяют их искусственное нацеливание на эндотелиальные клетки сосудов. Примером может служить нереплицирующийся аденовирусный вектор Ad5 с делецией E1, модифицированный мышиным промотором (PPE-1-3X), трансгеном Fas и рецептором фактора некроза опухоли человека 1 (tumor necrosis factor receptor 1, TNFR1). Данный вектор, получивший название VB-111, инфицируя ангиогенную сосудистую сеть, показал противоопухолевый эффект в клинических испытаниях [70]. Противоопухолевый эффект показан также для аденовируса FGF2-Ad-TK, экспрессирующего HSV-TK, который нацелен на фактор роста фибробластов 2 (fibroblast growth factor, FGF2) [71]. В онколитических векторах HSV1 для снижения нейровирулентности удаляют ген γ34.5, что приводит к эффективной избирательной репликации вируса только в делящихся клетках [72]. Антиангиогенные HSV1 экспрессируют ингибиторы ангиогенеза или нацелены на проангиогенные факторы [78]. Показано, что модифицированный VV (JX-594), избирательно нацеленный на сосудистую сеть опухоли с активацией сигнального пути ras/MAPK, при внутривенном введении вызывал коллапс сосудов опухоли [73]. Вирус JX-594, экспрессирующий транс-гены hGM CSF и β-галактозидазу, при внутривенном введении мышам реплицировался в эндотелиальных клетках сосудов опухоли, вызывая ее некроз. Эффективное подавление роста опухоли также наблюдалось при комбинированном применении мутантного VSV (VSVDelta51) с агентом, разрушающим сосуды ZD6126 [75].
Одна из проблем лечения рака – рецидив заболевания, обусловленный наличием в опухоли клеток, резистентных к традиционным методам лечения [79]. По свойствам эти клетки имеют много общего с нормальными стволовыми клетками, поэтому их называют раковыми стволовыми клетками (cancer stem cells, CSC) [80]. Эти клетки могут самообновляться, обладают полипотентностью и могут оставаться в состоянии покоя, не делясь в течение длительного времени [81]. CSC клетки были выделены из таких солидных опухолей как рак легких, печени, головы и шеи, подже-лудочной железы, меланомы и саркомы [82]. Однако CSC клетки могут быть чувствительны к инфекции, вызванной онколитическими вирусами. Например, вирус Zika семейства Flaviviridae инфицировал стволовые клетки глиобластомы [83]. Для аденовируса, экспрессирующего белок, ответственный за аутофагию, Beclin-1, была показана способность вызывать аутофагию как CSC, так и нормальных клеток [84].
Эффективным направлением в онкотерапии является сочетанное применение онколитических вирусов с иммунотерапией, которую проводят с помощью моноклональных антител (mAb), ингибирующих контрольные точки, служащие ключевыми регуляторами иммунной системы. Первым иммуномодулятором, показавшим положительный эффект при лечении меланомы, было mAb ипилимумаб (ipilimumab) – ингибитор цитотоксического Т-лимфоцит-ассоциированного белка 4 (cytotoxic T-lymphocyte associated protein 4, CTLA 4), который ингибирует раннюю активацию и пролиферацию Т-клеток [85]. Показано, что пембролизумаб/ниволумаб подавляет Т-клетки за счет ингибирования белка 1 программируемой гибели клеток (protein death 1, PD1) [86, 87]. Комбинирование препарата T-VEC, полученного на основе вируса HSV1, с ипилимумабом или пембролизумабом позволило изменить противо-опухолевый иммунитет и усилить противоопухолевый эффект T-VEC при лечении пациентов с метастазами меланомы головного мозга, когда традиционные химиотерапевтические агенты были неэффективны [88, 89].
Таким образом, в лечении злокачественных новообразований онколитическими вирусами можно выделить ряд преимуществ по сравнению с существующими методами терапии:
Благодаря возможности локального введения, более высокой избирательной клеточной направленности и введения генетических модификаций вирусы-онколитики могут избирательно уничтожать клетки опухоли, в том числе CSC, но не здоровые клетки макроорганизма – в отличие от химио-и лучевой терапии.
Для целенаправленного уничтожения отдаленных метастазов возможно применение слабовирулентных аттенуированных вирусов, способных проникать через гематоэнцефалический барьер.
Онколитические вирусы могут быть адаптированы к типу опухоли и целенаправленно изменены генетически, что открывает широкие возможности создания противоопухолевых препаратов направленного действия против опухолей различной нозологии и локализации.
С помощью онколитических вирусов можно целенаправленно изменять экспрессию генов раковых клеток, что может привести к регрессии опухоли после их инфицирования вирусным онколитиком. С этой целью в вирусный геном искусственно интегрируют генетические элементы или целые клеточные гены, как, например, ген проапоптозного белка р53, ген белка апоптина, гены клеточных цитокинов, ген фактора некроза опухоли, гены-выключатели клеточного деления и др., изменяющие пролиферацию и/или вызывающие программируемую гибель раковых клеток [92-97].
Последовательное применение серии вирусов-онколитиков разных типов, так называемый принцип «кассетной виротерапии», позволяет осуществить поливалентное действие на опухоль с целью глубокого повреждения и искоренения опухоли и ее метастазов, а также воздействовать на устойчивые к химиотерапии «стволовые» раковые клетки.
Семейства цитолитических вирусов, обладающих онколитическим потенциалом
К наиболее изученным вирусам, обладающим онколитическим действием, относятся аденовирусы и герпесвирусы. Онколитическая активность аденовирусов показана в отношении большой группы злокачественных опухолей разного происхождения и различной локализации. На сегодняшний день группа аденовирусов, имеющих онколитический потенциал, является самой многочисленной, как и большое количество нозологий злокачественных новообразований, в отношении которых они показали положительный эффект. Разработанные препараты для разных семейств вирусов и проведенные клинические испытания представлены в Таблице 1.
Наибольшее количество онколитических препаратов создано на основе Ad5. Вирусные онколитики ONYX-015, Oncorine (H101), DNX2401 находятся в разных фазах (Ф) клинических испытаний на пациентах с плоскоклеточной карциномой головы и шеи, глиомой и аденокарциномой поджелудочной железы. Исследование эффективности Oncorine (H101) при внутриопухолевом введении в клиническом исследовании Ф3 позволило лицензировать данный препарат в Китае [105]. Последующее его применение в клиническом исследовании для лечения злокачественного плеврального выпота привело к полному выздоровлению 38% пациентов [151]. Многообещающие клинические результаты показаны для онколитиков ORCA-010 и GC0070. Основным недостатком этих препаратов является наличие высокого уровня нейтрализующих антител к данному вектору у пациентов, что может снизить их эффективность. Использование аденовируса шимпанзе или вирусов других типов, а также экранирование антигена дает возможность обойти эту проблему.
Широкие возможности генетических модификаций HSV1 обеспечиваются большим размером генома (около 150х103 пар нуклеотидов). Удаление генов, не существенных для репликации, позволяет вставлять в вирус трансгены, обеспечивающие онколитические свойства. Первый онколитический кандидат – вирус T-VEC (Talimogene laherparevec, коммерческое название Imlygic), официально зарегистрированный FDA и EMA для лечения неоперабельной меланомы. Препарат T-VEC создан на основе HSV1, в котором удалены гены, кодирующие белки ICP34.5 и ICP47 (infected cell protein, ICP), и встроено 2 копии гена белка человека hGM-CSF, который повышает презентацию опухолевого антигена дендритными клетками [152, 153]. В результате вирус заражает раковые, но не здоровые клетки [114]. Продолжаются клинические исследования (Ф1) с использованием T-VEC в качестве монопрепарата или в комбинации с ипилимумабом/пемброзумабом для лечения пациентов с плоскоклеточным раком. Еще один вирусный онколитик семейства Herpesviridae – спонтанный мутант HF-10, в геноме которого отсутствуют гены UL43, UL49.5, UL55, UL56 и LAT, что обеспечивает активную репродукцию вируса в раковых клетках [119, 120, 154]. За счет повышенной индукции CD4+, СD8+ и NK клеток HF-10 эффективно подавляет рост опухолей. В эксперименте показана его активность при внутриопухолевом и перитонеальном введении в отношении меланомы, аденокарциномы поджелудочной железы, плоскоклеточной карциномы головы и шеи, рака молочной железы [155]. Ко второму поколению онколитических вирусов, полученных на основе HSV1, относят вирус M032, экспрессирующий IL12 (interleukin), который проходит испытания (Ф1) по лечению глиомы [156]. Онколитическим вирусом третьего поколения является вирус G47∆, имеющий дополнительную делецию ICP47 по сравнению с вирусом G207 [124]. В настоящее время ведутся исследования по созданию генетических вариантов вируса герпеса и уже создана широкая панель кандидатов − вирусных вариантов направленного действия. Только для лечения опухоли глиобластомы разработано бо-лее 20 вирусных штаммов, которые находятся на разных стадиях клинических исследований [157]. Новые кандидаты, например ONCR-177, экспрессируют белки IL12, CCL4, FLT3LC и для повышения активации NK и T-клеток, доступности DC и предотвращения истощения T-клеток включают блокирующие последовательности анти-CTLA-4 и PD1. Для повышения активности онколитического вируса против глиомы создан кандидат С34, который, помимо делеции ICP34.5, содержит ген цитомегаловируса человека IRS1 [158]. В другой вирус RP1 для усиления противоопухолевой активности в отношении плоскоклеточной карциномы включены GM-CSF, фьюзогенный мембранный белок вируса лейкемии гиббонов GALV-GP/R. Дальнейшая модификация (вирус RP2) предусматривала экспрессию анти-CTLA-4 [159].
Перспективны для создания онколитических вирусов вакцинные штаммы парамиксовирусов, пикорнавирусов, поксвирусов и аденовирусов. Вирусы указанных семейств (как вакцинные штаммы, так и их дикие предшественники) обладают способностью реплицироваться в злокачественных клетках нейрогенного происхождения, что делает их перспективными кандидатами для разработки вирусов-онколитиков для лечения опухолей головного мозга и церебральных метастазов рака [160, 161]. Различные генетически модифицированные вирусы на основе вакцинных штаммов показали свою эффективность в отношении широкого ряда злокачественных новообразований (Таблица 1). Вирусный онколитик семейства Paramyxoviridae (MV-CEA) прошел клинические испытания (Ф1) на пациентках с раком яичников.
Онколитик семейства Poxviridae JX-594 (известный как Pexa Vec) успешно прошел клинические испытания (Ф1) на больных с рефракторным метастатическим колоректальным раком, гепатоцеллюлярной аденокарциномой, нейробластомой и солидными опухолями. Однако клинические испытания (Ф3) на пациентах с запущенной гепатоцеллюлярной карциномой не показали клинической эффективности и были прерваны. Вирусный онколитик семейства Poxviridae GL-ONC1 находится в клинических испытаниях (Ф1) на пациентах с плоскоклеточной карциномой головы и шеи и перитонеальным канцероматозом.
Реовирусы поражают клетки опухолей, в которых активирован проонкогенный Ras-зависимый сигнальный путь, который обеспечивает избирательное ингибирование фосфорилирования протеинкиназы R (protein kinase, PKR), способствуя размножению вируса [162]. На основе реовируса типа 3 создан препарат Реолизин (Reolysin), позднее получивший название Pelareorep, который показал активность в отношении многих злокачественных опухолей. Важным свойством реовируса является его способность преодолевать гематоэнцефалический барьер и проникать в клетки первичной опухоли и клетки метастазов в головном мозге [163, 164]. Реолизин находится в клинических испытаниях (Ф2) на больных с внутрипротоковой аденокарциномой поджелудочной железы, раком молочной железы и меланомой.
В лечении злокачественных опухолей находят применение вирусы гриппа А – вакцинные штаммы вируса гриппа человека или вирусы гриппа птиц. В пилотном эксперименте был показан положительный терапевтический эффект при использовании вируса с измененным геном, кодирующим белок NS1, на модели внутрикожных имплантов меланомы у мышей, а также против не мелкоклеточного рака легкого в экспериментах на трансгенных иммунокомпетентных мышах [41, 165] . К 12-му дню после заражения количество опухолевой массы в легких мышей снижалось на 70% по сравнению с неинфицированными животными [165]. Дефект вирусного белка NS1 приводил к нарушению механизма подавления инфекции клеточным IFN и активации апоптоза опухолевых клеток, что позволило сделать предположение об усилении прововоспалительного и противоопухолевого действия вируса с такой модификацией [27, 39].
VSV семейства Rhabdoviridae инфицирует клетки с дефектами в сигнальном пути IFN, в том числе раковые клетки, вызывая их лизис путем индукции апоптоза. В эксперименте выявлен положительный эффект применения онколитических вирусов на основе VSV в отношении немелкоклеточного рака легкого, рака эндометрия и лейкозов (Т-клеточного лейкоза, острого миелоидного лейкоза). Вирусные онколитики семейства Rhabdoviridae исследуют в клеточных линиях (HEC-1-A, Ishikawa, KLE), в экспериментальных моделях на мышах, производных рака эндометрия [148-150]. Опухолевая специфичность семейства рабдовирусов и парвовирусов представлена в Таблице 1.
Клинические испытания онколитических вирусов в отношении различных нозологических форм рака
Наибольшее число клинических исследований онколитических вирусов проведено в отношении меланомы и злокачественных новообразований желудочно-кишечного тракта. Как правило, клинические испытания проводятся на когортах больных с заболеваниями III и IV стадии, пациентах с метастазами и рецидивами. У пациентов с меланомой (III и IV стадии), глиомой и аденокарциномой поджелудочной железы неблагоприятный прогноз заболевания и высокая смертность. Глиома и аденокарцинома поджелудочной железы часто диагностируются на поздних стадиях заболевания, когда основные методы терапии неэффективны. Наибольший прогресс в использовании вирусных онколитиков достигнут в отношении данных нозологических форм рака. Возможно, это объясняет проведение большего числа клинических испытаний [166].
Лечение меланомы
Меланома (меланокарцинома, меланосаркома) – это злокачественная опухоль, развивающаяся из клеток, продуцирующих меланин, – меланоцитов и меланобластов. Опухоль локализуется преимущественно на коже, реже на сетчатке глаза и на слизистых оболочках, часто рецидивирует и быстро метастазирует лимфогенным и гематогенным путем во все органы. Меланома характеризуется большим разнообразием гистологического строения и клинических проявлений. Хирургическое иссечение меланомы позволяет излечить опухоль на ранних стадиях, но неэффективно для терапии метастатической меланомы. Меланома плохо поддается лучевой и химиотерапии. Применяемые схемы лечения дакарбазином дают скорость объективного ответа (objective response rate, ORR – доля больных, у которых наблюдается объективный ответ (суммарный ответ: полный + частичный + стабилизация)) только в 15% случаев и продлевают ремиссию на 5 лет. Например, при метастатической меланоме без мутаций в гене BRAF для терапии первой линии используют ингибиторы контрольной точки иммунного ответа (ипилимумаб, пембролизумаб и ниволумаб). Применение ниволумаба и ипилимумаба дает ORR 18% [167]. Предполагаемая 5-летняя выживаемость пациентов с ранней меланомой составляет 98%, при распространении меланомы в лимфатические узлы – 68%, при метастазировании в отдаленные органы – 30%. Смертность от меланомы составляет 15-20%. Согласно данным Аме-риканского онкологического общества, продолжительность жизни пациентов с меланомой III и IV стадии при наличии метастазов составляет без лечения около 4 месяцев, после стандартных методов лечения (хирургический метод, химиотерапия) – 6-8 месяцев [168].
Препарат Imlygic успешно прошел три фазы клинических испытаний у пациентов с меланомой и в 2015 году был одобрен FDA и ЕМА для клинического использования [16]. Клинические испытания проводили на когорте больных с меланомой III и IV стадии (по классификации Classification of Malignant Tumors, TNM и American Joint Committee on Cancer, AJCC) при наличии метастазов (Таблица 2). Вирус вводили в опухоль или подкожно. В испытаниях (Ф1) приняли участие 9 пациентов, серонегативных к HSV, с метастатической меланомой. Два пациента показали стабильный положительный эффект [169]. В испытаниях (Ф2) приняло участие 50 пациентов с неоперабельной меланомой (IIIс-IV стадии). ORR составила 26%, при этом было 8 пациентов с полным ответом и 5 – с частичным. Общая выживаемость (overall survival rate, OSR), определяемая как процент живых пациентов в течение выбранного промежут-ка времени, после постановки диагноза составила 58% через год и 52% через 2 года [170]. В клинических испытаниях (Ф3) приняли участие 436 пациентов с меланомой (IIIb-IV). Частота устойчивого ответа на терапию (durable response rate, DRR) составила 16.3%. Медиана общей выживаемости (median overall survival, mOS) – период времени от начала лечения или с момента постановки диагноза, в течение которого половина пациентов остаются живы, – составила 23.3 месяца [115]. Дополнительно проводились исследования Т-VEC в комбинации с моноклональными антителами анти-CTLA-4 (ipilimumab) и анти-PD1 (pembrolixzumab) у больных с прогрессирующей меланомой IIIb и IV стадии. В клинических испытаниях (Ф1) при комбинированной терапии T-VEC с ипилимумабом 8 пациентов ORR составила 50%, OSR – 67% через 1.5 года [170]. В исследованиях фазы Ф2 приняло участие 198 пациентов, ORR составила 39% (ORR монотерапии ипилимумабом составляет лишь 18%) [167]. При комбинированной терапии T-VEC с пем-бролизумабом (Ф1) для 21 пациента ORR составила 48% [170]. Таким образом, Imlygic является эффективным препаратом для лечения прогрессирующей меланомы в виде монопрепарата, но комбинация с иммунотерапией повышает эффективность.
| Вирус-онколитик | Характеристика лечебного курса | ||||
|---|---|---|---|---|---|
| Фаза клинических испытаний, Ф | Число больных | Тип опухоли, стадия | Способ введения | ORR (%); mOS (мес.) | |
| Т-VEC | Ф1 | 9 | Метастатическая меланома | в/о | 2 пациента со стабильным положительным эффектом |
| Ф2 | 50 | Меланома IIIc, IV | в/о | 26%; 12 месяцев | |
| Ф3 | 436 | Меланома IIIb, IIIc, IV | 295 пациентов – в/о 141 пациент – п/к | 26.4%; 23.3 месяца | |
| HF10 (Canepraturev-C-REV) | Ф1 | 28 | Метастатическая меланома | в/о | 66.7%; 34.6 месяца |
| Ф2 (+ipilimumab) | 46 | Метастатическая меланома | в/о | 41%; 21.8 месяца | |
| Coxackievirus A21 (CAVATAK) | Ф2 | 57 | Меланома IIIc, IV | в/о | 28%; 6 месяцев |
| Pelareorep (Reolysin) | Ф2 Ф2 (+carboplatin/paclitaxel) | 21 14 | Метастатическая меланома | в/в | 21%; 5.2 /10.9 месяца |
| Vaccinia GM-CSF (Pexa-VEC) | Ф1 | 12 | Меланома IV | в/о | 21% |
в/о – внутриопухолевый путь введения, в/в – внутривенный путь введения, п/к – подкожный путь введения.
Аттенуированный вирусный онколитик HF-10 прошел две фазы клинических испытаний на пациентах с меланомой. В исследовании фазы Ф2 46 пациентов с меланомой (IIIb-IV стадии) лечили HF-10 с ипилимумабом. ORR составила 41%, mOS – 21.8 месяца (ORR при монотерапии ипилимумабом составляет всего 18%) [172, 173]. Таким образом, HF-10 является перспективным вирусным онколитиком для лечения меланомы, особенно в сочетании с иммунотерапией.
Онколитик Pelareorep (Reolysin), полученный на основе реовирусов, прошел две фазы клинических испытаний для больных с меланомой при внутривенном способе введения. В исследованиях (Ф2, 21 пациент) монотерапия Reolysin оказалась неэффективна, так как онколитик индуцировал выработку нейтрализующих антиреовирусных антител (neutralizing anti-reovirus antibody, NARA), что, возможно, ограничивало эффективность репликации вируса и онколитический эффект [174, 175]. В исследовании фазы Ф2 (14 пациентов с прогрессирующей меланомой) при комбинированной терапии Reolysin/Carboplatin (Paclitaxel) ORR составила 21%, mOS – 5.2 месяца (Reolysin+Carboplatin) и 10.9 месяца (Reolysin+Paclitaxel). При монотерапии Carboplatin/Paclitaxel в других клинических исследованиях mOS составила 3 и 9 месяцев [176, 177]. Как видно из представленных данных, применение реовирусов для лечения меланомы требует дополнительных исследований.
Клинические испытания с рекомбинантным вирусом Vaccinia-GM-CSF были проведены с участием больных с метастатической меланомой. Вирус хорошо реплицировался в раковых клетках, вызывая воспалительную лимфоцитарную инфильтрацию и опухолевый некроз [178]. В испытаниях фазы Ф1 (12 пациентов) при внутриопухолевом введении онколитика ORR составила 21%. Наблюдали усиление Т-клеточного иммунного ответа на меланома-специфические антигены (gp100 и MART-1) [178]. Онколитики на основе VV для лечения прогрессирующей меланомы также нуждаются в дополнительных исследованиях.
Лечение глиомы
Глиома – первичная опухоль головного мозга. Основным методом лечения глиом служит хирургический в комбинации с лучевой и химиотерапией. Клинические испытания с участием пациентов с глиомами немногочисленны вследствие развития осложнений после хирургических операций (изменения ментального статуса, нарушение речи, отек головного мозга). 10-летняя выживаемость с глиомой низкой степени злокачественности составляет 47%, mOS – 11.6 лет [179]. За счет агрессивного течения заболевания mOS пациентов с III степенью злокачественности глиомы составляет 3 года, с IV степенью злокачественности – от 6 до 15 месяцев [180].
Препарат G207, полученный на основе HSV, прошел клинические испытания (Ф1) (27 пациентов с глиобластомой), показав mOS 6.6 месяца (Таблица 3). При комбинации радиотерапии и G207 mOS составила 7.5 месяца [181]. Однако этот эффект сравним с применением при глиоме стандартных схем терапии без применения онколитических вирусов.
| Вирус-онколитик | Характеристика лечебного курса | ||||
|---|---|---|---|---|---|
| Фаза клинических испытаний, Ф | Число больных | Стадия опухоли | Способ введения | mOS (мес.) | |
| HSV 1716 (Seprehvir) | Ф1 | 9 | Злокачественная глиома | в/о | 24 мес. |
| Ф2 | нет данных | Рецидивирующая глиома у детей | в/о | нет данных | |
| G207 | Ф1a | 21 | Глиобластома | в/о | 6.6 мес. |
| Ф1b | 6 | Глиобластома | в/о | 6.6 мес. | |
| ONYX015 | Ф1 | 24 | Злокачественная глиома | в/о | 6.2 мес. |
| DNX-2401 | Ф1 | 25 | Рецидивирующая злокачественная глиома | в/о | 5 больных 36 мес. |
| Reolysin | Ф1 | 12 | Рецидивирующая злокачественная глиома III, IV степени | в/о | 1 больной 5 мес. 1 больной 54 мес. |
| NDV | Ф1 | 11 | Рецидивирующая глиобластома | в/в | 7 мес. |
в/о – внутриопухолевый путь введения, в/в – внутривенный путь введения.
В испытаниях фазы Ф1 (25 пациентов с рецидивирующей злокачественной глиомой) онколитик DNX-2401, полученный на основе Ad, показал mOS 36 месяцев. У трех пациентов размер опухоли уменьшился на 95% [106], что превышает результаты стандартного лечения, однако нуждается в дополнительных исследованиях.
Онколитик, созданный на основе NDV, штамм HUJ, в исследовании фазы Ф1 в отношении глиомы (11 больных с рецидивирующей глиобластомой) показал mOS 7 месяцев, что соответствует стандартному лечению [132].
Таким образом, лечение глиом вирусными онколитиками перспективно и требует подтверждения в исследованиях Ф2 и Ф3.
Лечение протоковой аденокарциномы поджелудочной железы
Протоковая аденокарцинома поджелудочной железы – злокачественное новообразование, которое трудно поддается лечению. Смертность в России составляет 3.4% [2]. Основными методами лечения является хирургическая резекция, лучевая и химиотерапия. Прогноз течения заболевания неблагоприятный, так как заболевание обычно распознают на поздней стадии. В микроокружении опухоли накапливаются иммуносупрессорные факторы, такие как Treg, M2 (опу-холь-ассоциированные макрофаги), IL10, трансформирующий фактор роста β (transforming growth factor β, TGFβ), которые ограничивают эффективность химио-и иммунотерапии рака поджелудочной железы. Пятилетняя выживаемость составляет 6% [1]. Клинические испытания ипилимумаба и гемцитабина у пациентов с протоковой аденокарциномой поджелудочной железы показали ORR 10.8% с mOS 10 месяцев [182].
Онколитические вирусы (герпесвирусы и реовирусы) показали противоопухолевый эффект в отношении рака поджелудочной железы (Таблица 4) [120, 183]. В испытаниях фазы Ф2 вирусного онколитика Reolysin приняли участие 34 пациента с протоковой аденокарциномой поджелудочной железы, mOS составила 10.2 месяца [142]. Полученные результаты не отличаются от результатов терапии моноклональными антителами. Reolysin может рассматриваться как перспективный кандидат лечения злокачественного новообразования, но необходимы клинические исследования с большим числом пациентов. Клинические испытания фазы Ф1 онколитических вирусов ONYX015, T-VEC, H-10 с участием пациентов с аденокарциномой поджелудочной железы продолжаются.
| Вирус-онколитик | Характеристика лечебного курса | ||||
|---|---|---|---|---|---|
| Фаза клинических испытаний, Ф | Число больных | Стадия опухоли | Способ введения | mOS (мес.) | |
| ONYX015 | Ф1 | 23 | Неоперабельная аденокарцинома | КТ управляемая инъекция | нет данных |
| Ф2 (+gemcitabin) | 21 | Прогрессирующая и метастатическая аденокарцинома | эндоскопический зонд в/в gemcitabin | 6 пациентов, частичный регресс опухоли | |
| Н10 | Ф1 | 8 | Поджелудочная аденокарцинома | в/о через катетер во время операции | 3 пациента, частичный регресс опухоли, 6 мес. |
| Т-VEC | Ф1 | 17 | Поджелудочная аденокарцинома | нет данных | нет данных |
| Reolysin | Ф2 | 34 | Поджелудочная аденокарцинома | в/в | 10.2 мес. |
в/о – внутриопухолевый путь введения, в/в – внутривенный путь введения.
Таким образом, ряд вирусных онколитиков (вирус герпеса и аденовирус) успешно прошли клинические испытания, и был показан положительный терапевтический эффект в отношении неоперабельной меланомы и плоскоклеточной карциномы головы и шеи при отсутствии выраженных побочных эффектов и общей токсичности. Один онколитический вирус может оказывать положительный терапевтический эффект в отношении нескольких гистологических форм опухоли, однако для достижения более сильного лечебного эффекта возможны комбинации с иммунотерапией.
